|
|
|
|
|
 |
|

|
|
|
qPCR技术介绍(四)——数据解析篇
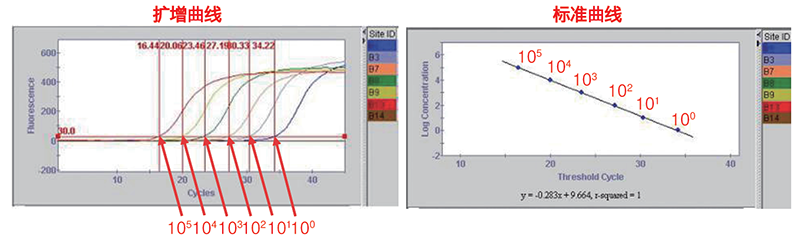
1.定量的基本原理 qPCR通过荧光信号值实时监控PCR扩增产物的变化,在指数扩增期进行定量分析。PCR每进行1个循环,DNA呈2倍的指数关系增长,不久达到平台期。假设起始DNA的量为A0,经过了n个循环后,理论上DNA产物的量可以表示为:An=A0×2n那么,起始DNA量A0越多,扩增产物的量便越早达到检出值An,达到An时的循环圈数即Ct值。也就是起始DNA量A0越多,扩增曲线越早起峰,对应需要的循环圈数n越小。 理论上,Ct值与起始模板数的对数值成反比线性关系。 我们将已知浓度的标准品进行梯度稀释,作为模板进行Real Time PCR,就会按照起始DNA量由多到少的顺序等间隔得到一系列扩增曲线。根据Ct值与起始模板数的对数值之间的线性关系,就可以制作出【标准曲线】。 未知浓度的样品的Ct值代入标准曲线,就可以求出未知浓度样品的起始模板量,这就是qPCR的定量原理。 2.标准曲线
进行绝对定量,需要使用浓度已知的标准品来制作标准曲线。
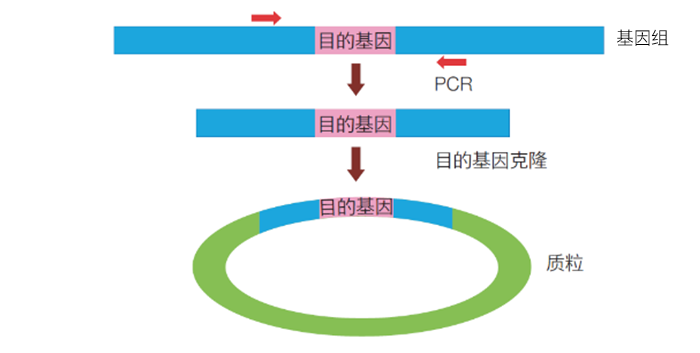
》标准品的制备 如果待检测的模板是基因组DNA,就要选择基因组DNA作为标准品。但很难获得目的基因浓度是已知的基因组DNA时,或者目的基因的丰度较低时,对于DNA起始的材料必须构建质粒。 所构建的质粒标准品,不仅要具有目的序列,还要在目的序列的两侧各多加一段序列,使其更加接近实际检测样品的结构,以保持与实际检测样品间的扩增效率的一致性。
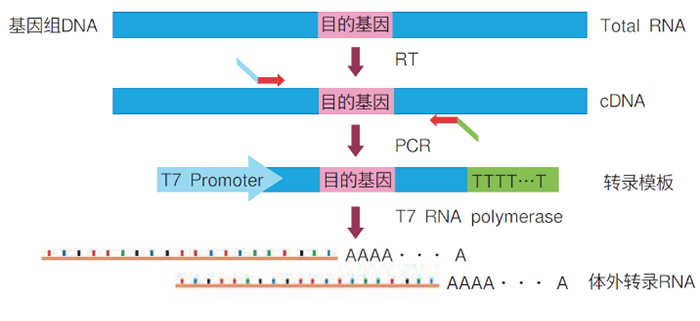
进行mRNA表达解析时,最好选择表达目的基因的Total RNA或以Total RNA为模板合成的cDNA作为标准品。但很难获得目的基因浓度是已知的的Total RNA时,必须构建体外转录RNA。
》标准曲线的制作
标准曲线的制作不需要人工操作,由仪器自动完成。
》理想的标准曲线
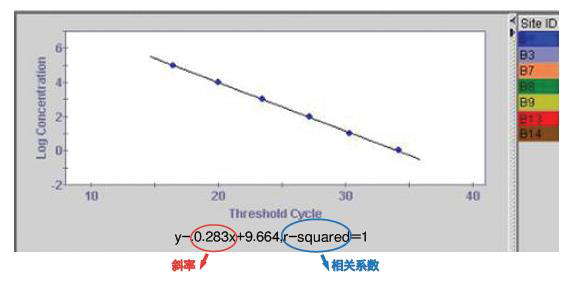
评价标准曲线的优劣有两个指标,相关系数(r 2)和斜率(slope)。 斜率反映PCR扩增效率(E),PCR理想的扩增效率应在0.9<E<1.1范围, 如果PCR扩增效率低时必须重新设计引物; 如果PCR扩增效率比理论值高时,说明反应体系中有可能存在对反转录反应或PCR反应的阻害物质,需要改进提取方法。
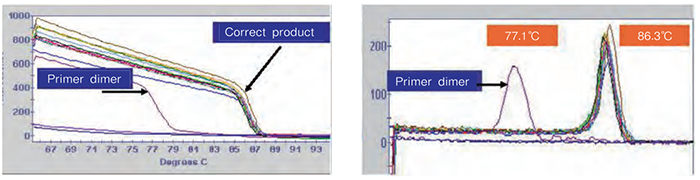
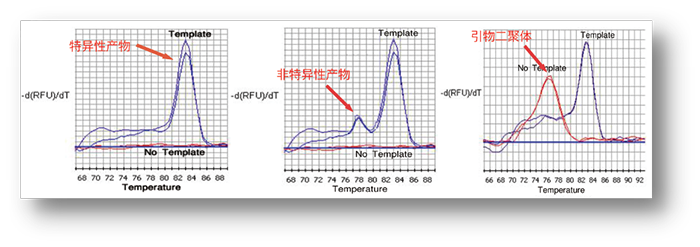
3.融解曲线 采用TB Green荧光嵌合法检测时,可以通过融解曲线分析,确认PCR反应的特异性。
》融解曲线分析的原理
左图为融解曲线的一次曲线,右图为融解曲线的负一次微分曲线,通常使用融解曲线的负一次微分曲线进行分析的较多。
Tm值与PCR扩增产物的序列有关,对于某一PCR扩增产物,其值是固定的。 理想的融解曲线应该是只有单一峰型的曲线,如果出现两个以上的峰型,说明有引物二聚体等非特异性扩增产生,需要对条件进行优化或重新设计引物。
|
| 更多详情请点击: |

|