基因敲除细胞株
KO细胞定制服务
作为实现基因功能缺失的重要调控方式,基因敲除(Knock out, KO)可完全消除目的基因的表达,使其蛋白完全不表达或功能彻底丧失,且可以更好地观察细胞表型的变化。但KO细胞株构建过程较为繁琐,实验周期长,且容易出现敲除效果不彻底的情况,导致研究进度受阻。
基于Smart-CRISPR™细胞基因编辑系统,定制KO细胞服务,可交付单克隆纯合子,快至1个月,满足您的早期筛选实验需求 。我们使用优化的转染体系将RNP(gRNA和Cas蛋白复合物)直接递送到细胞内,相比于质粒和病毒等CRISPR/Cas介导的方法,脱靶效率降低明显,能更精准地切割目标DNA序列。
2024年5月8日-6月30日期间,凡合作过基因编辑大小鼠项目的新老客户,活动期间订购KO细胞株均享优惠折扣,最高可立减8,000元;其中,若基因编辑大小鼠与细胞项目为同一基因,价格低至8,800元。点击订购
现货KO细胞库
赛业生物依托成熟的Smart-CRISPR™细胞基因编辑平台和完善的细胞培养体系,启动近2万个全基因组敲除细胞库构建计划,致力于为基础研究、抗体验证、药物筛选、疾病诊断、治疗和检测等方面提供大力支持。KO细胞库涵盖肿瘤、心血管、神经等20多种研究领域,现在下单现货KO细胞库,交付单克隆纯合子,快至1周发货!点击查询现货KO细胞
强大的算法赋能细胞的基因编辑项目
- AI辅助筛选Western Blot阴性单克隆
借助罕见病数据中心(RDDC)开发的RNA剪接模型工具,预测碱基序列突变后mRNA序列可能发生的剪切情况,辅助筛选ORF移码的单克隆,更好地规避在Western Blot环节检测出蛋白残留的风险。
应用案例
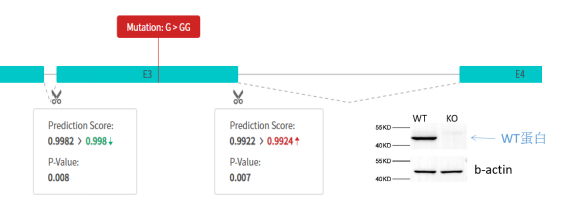
(1)RDDC分析目标克隆在gRNA位点插入4bp后产生选择性剪切识别位点,形成新的截短转录本,Western Blot检测到截短的蛋白,与RDDC预测结果一致。
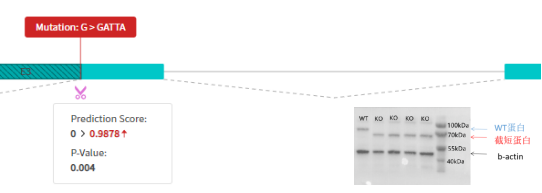
(2)RDDC分析目标克隆在gRNA位点插入1bp未产生选择性剪切识别位点,产生移码突变和提前终止,Western Blot检测蛋白为阴性,与RDDC预测结果一致。
- Smart-CRISPR™细胞基因编辑系统辅助方案设计
基于独创的Smart-CRISPR™技术,用户只需在系统中输入需要敲除的基因信息,即可得到自动化生成的方案设计,轻松实现基因敲除、基因敲入等多种策略,编辑效率高达90%。
服务特色
- 规模庞大、品种齐全的科研细胞库
| 类型 | 典型细胞株 | 交付标准 | 质控 |
|
肿瘤免疫细胞
|
Jurkat, HepG2, SK-MES-1等 | 1个单克隆纯合子细胞株2管(106/管),实验报告 | PCR+Sanger测序等 |
|
非癌永生化细胞
|
HK-2, AC16等 | 1个单克隆纯合子细胞株2管(106/管),实验报告 | PCR+Sanger测序等 |
|
诱导多能干细胞
|
iPSC | 1个单克隆纯合子细胞株2管(106/管),实验报告 | PCR+Sanger测序+免疫荧光等 |
|
干细胞
|
H1, H9 | 1个单克隆纯合子细胞株2管(106/管),实验报告 | PCR+Sanger测序+免疫荧光等 |
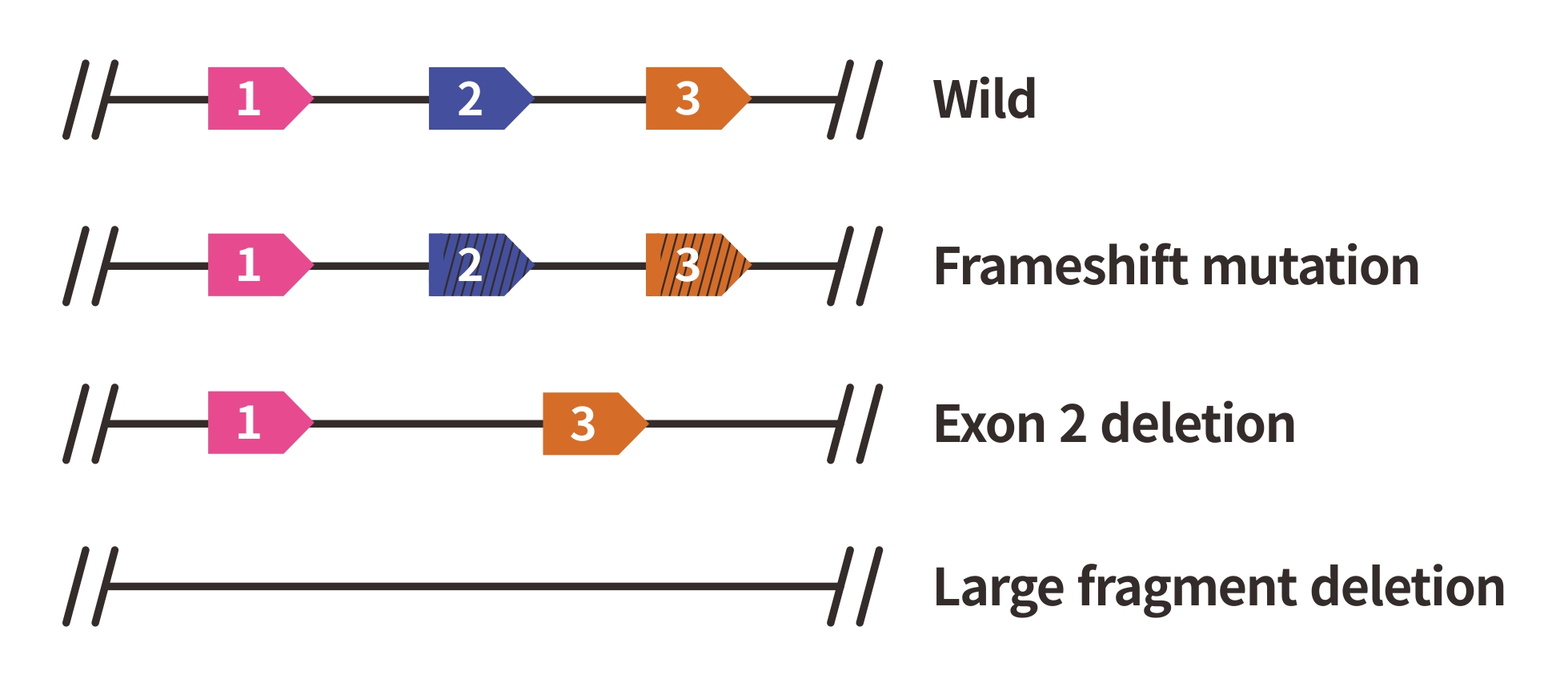
- 多种敲除策略
我们具备移码突变、片段敲除、多基因敲除等编辑技术能力,根据研究项目的基因和细胞信息的不同,采取最佳方案,极大提高目的基因敲除的成功率和蛋白的不表达效率。
- 优化实验流程,有效提升编辑效率
基因/细胞分析→sgRNA设计与合成→细胞电转及KO效果鉴定→单克隆化→测序分析→复检及扩增
体内体外基因编辑平台优势
- 采用RNP递送,脱靶效率低
相比于质粒或者病毒等基因敲除方法,RNP递送具有更高的特异性和编辑效率,准确靶向目的细胞,实现Cell pool/纯合子交付。
- 强大的AI算法赋能
基于Smart-CRISPR™细胞基因编辑系统,轻松实现基因敲除、基因敲入等多种策略,编辑效率高达90%;由罕见病数据中心(RDDC)开发的RNA剪接模型工具提供支持,辅助筛选WB阴性克隆。
- 成熟的技术平台
从体内动物实验到体外细胞实验,拥有上万例成功基因编辑项目经验和多篇文献引用发表,可提供从细胞基因表达调控、细胞功能验证、小鼠疾病模型构建及表型分析的全流程服务。
- 严格的质量控制体系
进行细菌、支原体等微生物的双重检测,确保100%无污染,并充分鉴定基因编辑效果;进行细胞活率检测,保证交付质量。
- 专业的项目管理
24h内即可出方案,定期反馈项目进展,配备博士团队予以技术支持,提供详尽的交付报告,可根据要求交付不同克隆(纯合子、杂合子和对照)细胞。
服务案例
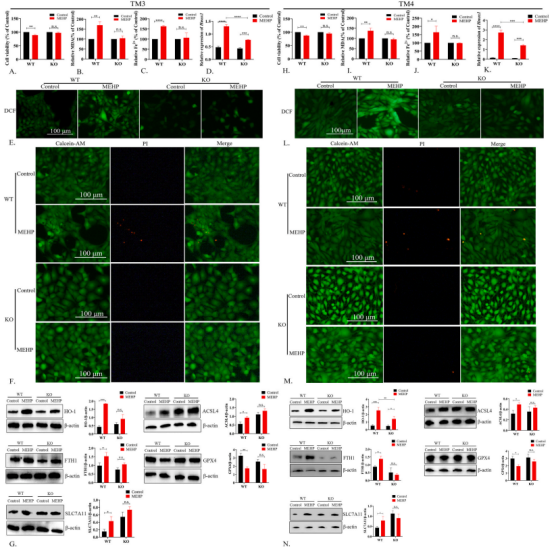
- 体外敲除HIF-1α基因以验证其调控机制
Di-(2-ethylhexyl) phthalate exposure leads to ferroptosis via the HIF-1α/HO-1 signaling pathway in mouse testes.
研究人员构建了HIF-1α基因敲除的Leydig和Sertoli细胞系,通过Sanger测序和Western blotting检测,确认了敲除细胞系中的HIF-1α被成功敲除。与野生型细胞相比,HIF-1α-KO细胞系在MEHP刺激下细胞活力受损的程度有明显改善。同时,脂质过氧化和亚铁超载也受到抑制。分别使用qPCR和Western印迹法评估Hmox1和HO-1水平的表达,发现敲除Hif-1α能逆转MEHP刺激下的Hmox1和HO-1表达水平上调。此外,MEHP刺激后ROS爆发和细胞死亡程度也在敲除HIF-1α后减弱。Western印迹显示敲除HIF-1α恢复了ACSL4、FTH1和SLC7A11的表达,以及抑制GPX4的表达。由此表明,MEHP刺激以HIF-1α依赖的方式导致睾丸Leydig和Sertoli细胞的铁死亡。