对于CAR-T细胞治疗,CAR分子是影响治疗有效性的关键。CAR分子结构包含识别肿瘤抗原的抗体单链可变区、铰链区,以及胞内的共刺激结构域、信号传导域,其设计的合理性会影响CAR-T细胞的杀伤效应、体内持久性、以及安全性等。因此,针对不同的肿瘤治疗靶点,我们需要设计合理有效的CAR分子,并包装成CAR慢病毒,用于后续CAR-T细胞的构建。
CD19抗原慢病毒包装及滴度检测
将表达CD19抗原的慢病毒纯化液进行梯度稀释(0.01、0.1、1、10
μl),分别加入到相同数量的293T细胞中,72小时后流式检测293T细胞阳性率,进而按如下公式计算慢病毒的转导滴度:

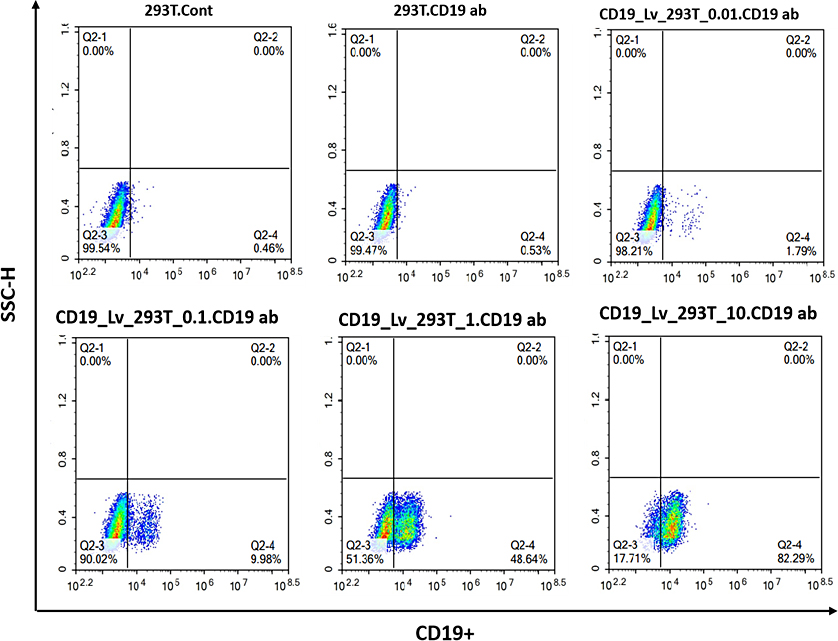
图1. CD19抗原慢病毒滴度检测结果
如图所示,CD19抗原阳性细胞的数量随转染病毒梯度的增加而逐渐升高,表明该慢病毒有良好的感染活性,并按上述公式计算病毒滴度为:1.4×108
Tu/ml。
CD19-293T稳转细胞株构建
我们将成功制备的上述CD19病毒转染293T细胞,经过多轮筛选获得阳性率几乎为100%的CD19-293T细胞,其阳性率检测结果如下图所示。
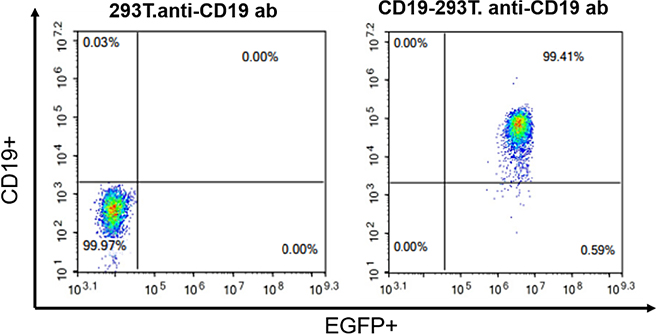
图2. CD19-293T稳转细胞株阳性率检测结果
CD19-CAR慢病毒包装及滴度检测
我们将针对CD19靶点设计的二代经典CAR分子构建到慢病毒载体中,并包装得到CD19-CAR慢病毒,采用上述方法检测病毒滴度,经计算后得到病毒滴度为:4.33×108
Tu/ml。

图3. CD19 CAR分子结构,其中VH和VL序列来源于CD19抗体FMC63克隆
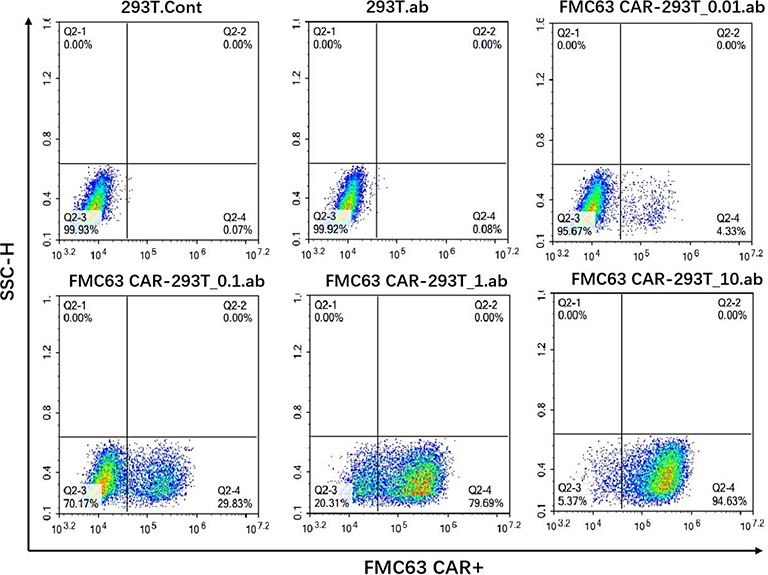
图4. CD19 CAR慢病毒滴度检测结果
在完成CAR病毒的包装后,下一步需对T细胞进行细胞转染,从而获得CAR-T细胞。我们建立了两种不同的高效的T细胞制备方法,均能制备高纯度的T细胞(CD3+细胞占比可达98%以上),但二者扩增出来的不同亚型T细胞的占比有较大的差异,Method
1扩增出来的T细胞以CD8+T细胞亚型为主,而Method
2可扩增出CD8+T细胞和CD4+T细胞占比差异较小的T细胞群体,这两种方法为研究不同亚型T细胞的作用奠定了坚实的基础。
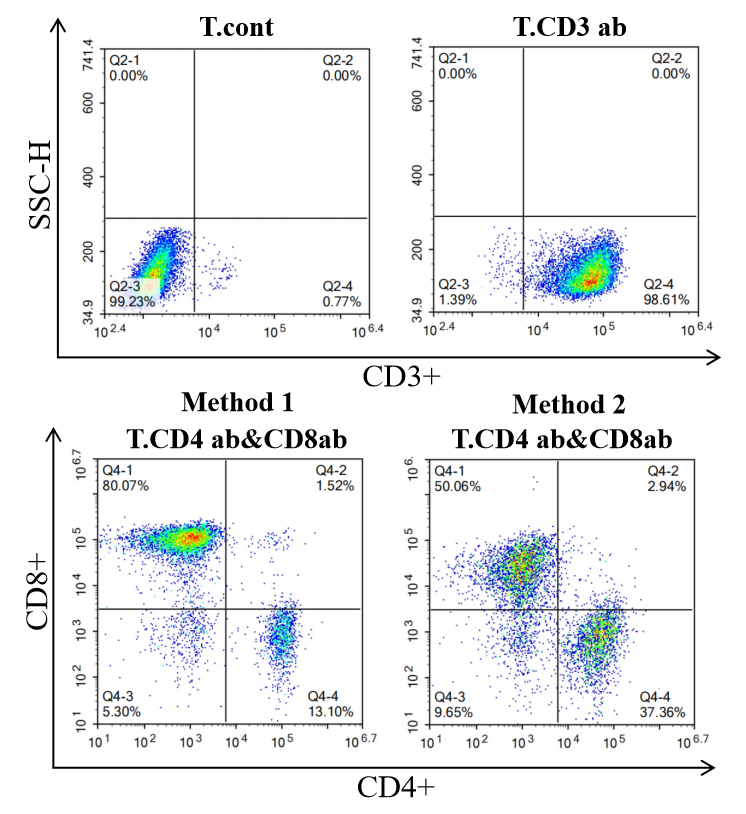
图6. T细胞表型分析实验结果
慢病毒是目前构建CAR-T细胞的重要基因递送工具,不同的T细胞活化扩增方法、不同的转染时间等多方面因素都会影响CAR-T细胞的阳性率。我们通过多方面的实验条件优化,成功建立了高效的基于慢病毒转染的CAR-T细胞制备工艺。下图展示的是CD19
CAR-T细胞阳性率检测结果,该结构中使用了来源于CD19抗体FCM63克隆的scFv,因此可通过抗FMC63
scFv抗体对其转染效率进行检测,结果表明CD19
CAR-T细胞的阳性率可达45.59%,表明成功构建了阳性率较高的CD19 CAR-T细胞。
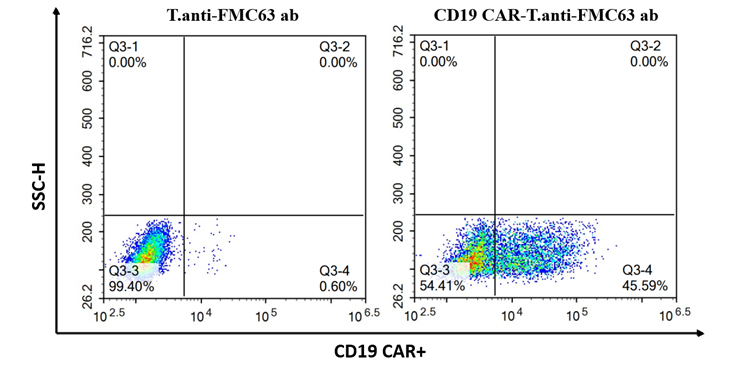
图7. CD19 CAR-T细胞阳性率检测结果
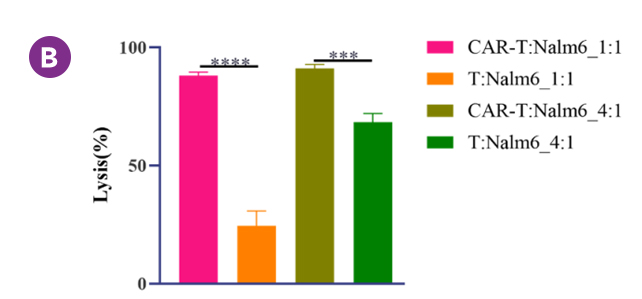
构建好CAR-T细胞即可进行相关的药效评价,通常采用不同的效靶比,观察CAR-T细胞对靶细胞的杀伤作用。我们将CD19
CAR-T细胞和T细胞分别以不同效靶比同Nalm6细胞共孵育48h,采用流式法检测肿瘤细胞凋亡。如图所示,与T细胞组相比,不同效靶比条件下,CD19
CAR-T细胞均展现出了对Nalm6细胞明显增强的特异性细胞毒性作用。
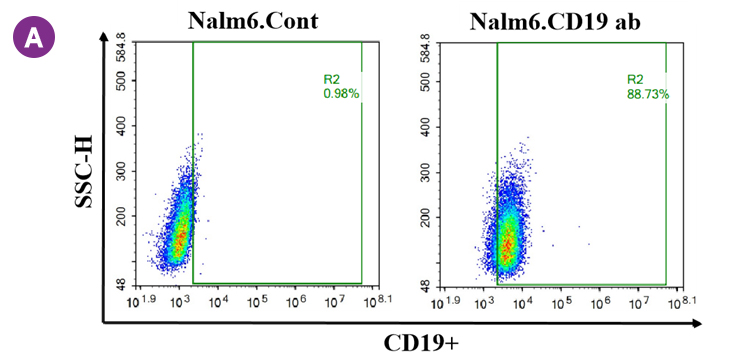
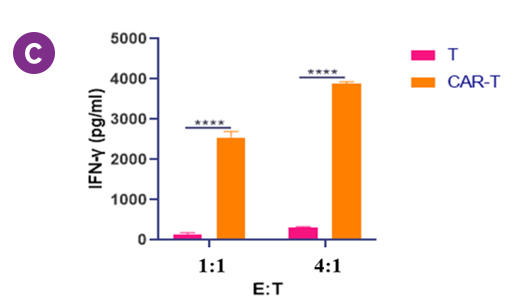
图8. FMC63 CAR-T细胞杀伤Nalm6肿瘤细胞实验结果
A. Nalm6细胞表面CD19抗原阳性率检测结果;B. CD19 CAR-T细胞杀伤Nlam6细胞实验结果;
C. CD19 CAR-T细胞杀伤Nlam6细胞培养上清中IFN-γ含量检测结果