|
||||

|
||||
|
得克萨斯大学圣安东尼奥健康科学中心微生物学、免疫学和分子遗传学系Xiang, Yan教授课题组长期从事抗病毒免疫机制和病毒免疫逃逸策略的研究。近期该课题组发表了名为“Human SAMD9 is a poxvirus-activatable anticodon nuclease inhibiting codon-specific protein synthesis”的研究性论文。该论文通过前期研究发现,人类SAMD9 N端domain是一种抗密码子核酸酶(ACNase),可特异性切割苯丙氨酸tRNA(tRNA-Phe)被2′-O-甲基化修饰的摆动解码位点,进一步应用 tRNA-seq和 ribo-seq发现,这导致tRNA-Phe表达下调和密码子特异性核糖体暂停和压力应激信号传导。在细胞中,SMAD9的ACNase酶活性通常是潜伏状态,但在痘病毒感染或疾病状态下发生SMAD9突变时会被激活,揭示了tRNA-Phe耗竭可以作为抗病毒机制和SMAD9突变疾病的致病条件。 该研究成果于2023年6月发表在学术期刊Science Advances(IF: 13.6)上(康成生物|数谱生物可提供文章所采用的tRNA-seq技术服务平台)。
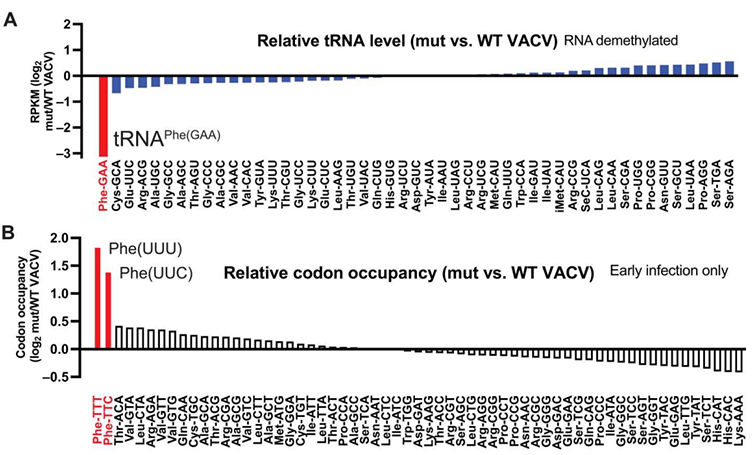
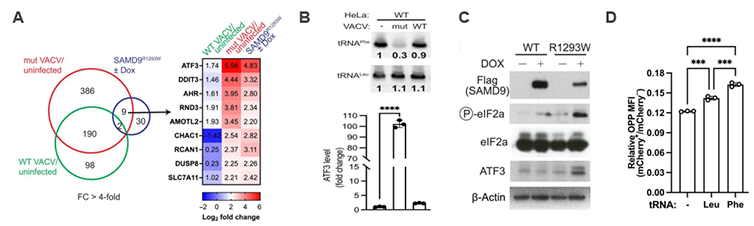
研究背景 tRNA是蛋白翻译元件的基本组成分子,tRNA运载氨基酸进入核糖体,其自身的反密码子(anticodon)通过序列互补配对识别mRNA上的三联密码子(codon),从而将mRNA上的蛋白编码序列解码,合成蛋白质。除此之外,它们也是微生物用来阻止病毒感染、减轻细胞应激或消除竞争生物的蛋白质毒素的主要靶标。作为针对病毒或竞争对手的防御策略,一些微生物使用抗密码子核酸酶(ACNase)来消耗必需的tRNA,它们在反密码子环处切割tRNA,导致细胞中特定tRNA的消耗和蛋白质合成中的阻断,从而有效地防止外源干扰对自身的影响。然而,在多细胞真核生物中尚未观察到这种机制。 在脊椎动物中,干扰素调节的天然免疫系统是抵御病毒的第一道防线,干扰素刺激诱导产生的抗病毒因子可以作为病毒的抑制因子,阻止病毒的复制。例如哺乳动物干扰素刺激的产物SAMD9和SAMD9L是痘病毒VACV(包括猴痘病毒和牛痘病毒在内的DNA病毒家族)的有效抑制因子,但是具体的抑制机制并不完全清楚,本篇文章表明,SAMD9能够通过类ACNase的机制,切割细胞内特定的tRNA,从而达到抑制痘病毒复制的效果。 研究思路 1. 前期实验:SMAD9具有ACNase活性 文章前期实验通过人类全基因组 RNA 干扰筛选鉴定,并利用HeLa 细胞中的单个基因敲除证实,SAMD9、WDR6和 FTSJ1可以抑制VACV 突变体(不能产生宿主 SAMD9/9L 抑制分子)的生长。FTSJ1是甲基化转移酶,可以与WDR6互作,为tRNA的反密码子摆动解码位点34位碱基添加2’-O-me修饰。通过体外切割电泳迁移实验,结构解析等发现SMAD9的N端134-385位氨基酸具有ACNase活性,在野生型VACV感染的情况下被激活,可以结合具有2’-O-me修饰的tRNA并进行切割,导致tRNA表达降低。 2. tRNA-seq和ribo-seq高通量筛选及验证 为了全面评估SAMD9对细胞内tRNA的影响,文章使用改良的tRNA测序 筛选感染VACV的细胞中的tRNA水平。相对于感染野生型 VACV的细胞,突变型VACA感染的细胞,具有34位2’-O-me修饰的tRNA-Phe表达水平显著降低了近10倍,但其他tRNA则没有明显的变化。文章进而利用 Ribo-seq来探究tRNA-Phe的耗竭是否影响了核糖体在tRNA-Phe解码的密码子处的停滞及整体蛋白合成,发现相对于感染野生型VACV的细胞,突变型VACA感染的细胞在解码Phe的密码子位置的reads密度明显增加,说明由于突变型VACA无法抑制SMAD9。因而激活的SMAD9可以切割tRNA-Phe,tRNA耗竭导致了Phe密码子处的核糖体停滞。多柔比星Dox可以诱导野生型SMAD9表达,利用 Ribo-seq筛选和Northern blot验证探究了过表达R1293W 突变型SAMD9(无切割活性)的BT20细胞在Dox诱导前后的变化,也发现了Dox诱导激活了野生型SMAD9切割tRNA,tRNA耗竭导致了Phe密码子处核糖体停滞。 3. 功能机制实验:活化的SAMD9触发核糖毒性应激,影响整体蛋白合成 为了找出SAMD9激活下游通路基因,文章对感染野生型VACV前后、感染突变型VACA前后的HeLa细胞进行了转录组分析,并将其与过表达R1293W 突变型SAMD9的Dox处理前后的Hela细胞转录组差异基因取交集,发现有9个基因是感染野生型VACV后下调,感染突变型VACA及过表达R1293W 突变型SAMD9的Dox处理后hela细胞上调的,其中ATF3变化超过60倍,qPCR验证趋势相符,同时作者也观察到了eIF2α磷酸化的现象。由于ATF3表达升高以及eIF2α磷酸化是核糖体碰撞和随后的核糖毒性应激的特征,因此作者认为活化的SAMD9能够导致持续的核糖体停滞,进而引发核糖体碰撞和随后的核糖毒性应激,从而抑制蛋白合成与病毒的复制。进一步作者通过tRNA Phe的敲低及过表达实验证明SAMD9是通过切割tRNA Phe来发挥上述功能的。 技术路线
结果展示 1.tRNA-seq和ribo-seq高通量筛选
图1. A. tRNA测序筛选突变vs野生型VACV感染前后差异的tRNA, tRNA-Phe-GAA在突变VACV感染后下调显著; 2.功能机制实验:活化的SAMD9触发核糖毒性应激,影响整体蛋白合成
图2. 功能机制实验:活化的SAMD9触发核糖毒性应激,影响整体蛋白合成 研究意义 文章发现SMAD9在突变型VACV感染后,可以激活ACNase活性,结合具有2’-O-me修饰的tRNA并进行切割,导致tRNA表达降低;但感染野生型VACV,病毒可以产生SMAD9抑制剂,抵抗tRNA切割。作者后续通过 tRNA测序和Ribo-seq进行筛选,找到了受SMAD9调控的靶tRNA-Phe,tRNA-Phe的耗竭导致核糖体在tRNA-Phe解码的密码子UUU和UUC处发生停滞。功能机制研究发现,活化的SAMD9切割tRNA-Phe导致其表达下调,激活ATF3和eIF2a磷酸化,触发核糖毒性应激反应,影响整体蛋白合成,进而抵抗病毒的感染。总体而言,这项工作思路清晰,数据详实,具有很高的科研价值与应用价值,为tRNA剪切和修饰的研究提供了新的思路与方法。 原文出处
|
| 康成生物 | 数谱生物 地 址:上海市闵行区陈行公路2168号10C幢4楼 免费电话:400-886-5058 / 800-820-5058 电 话:021-64451989 网 址:www.aksomics.com |

|

|