
抗体研发的必由之路——高通量快速克隆
单克隆抗体(mAb)是用于靶向治疗癌症和神经退行性疾病以及其他疾病的一类需求不断增长的制剂。因此,开发快速有效的克隆、表达和筛选mAb的方法是至关重要的,因为最初的筛选过程可能涉及数千个mAb。从单个B细胞可变区中分离cDNA,然后将这些区域克隆到表达载体中的工作流程已逐渐普及。尽管这个流程只需要单轮克隆,但使用传统的克隆和表达方法可能会限制所生成抗体的数量。
传统酶切连接的克隆方法常存在缺陷:大片段连接效率低,核苷酸有缺口,缺乏方向性以及载体/插入片段制备耗时。在研究某一个抗体时,这些缺陷造成的总体工作负荷延长可能还可以接受,但扩展至成百上千个克隆的高通量应用时问题就比较严重了,因为扩大化该工作流程就意味着扩大其潜在问题和增加了大量的故障排除工作。
Takara的In-Fusion Cloning是一种无需连接酶、高效率的无缝克隆技术,基于载体和插入片段序列之间的同源重组原理,有助于快速、高效地将任意PCR片段克隆到任意目的载体中,背景低,克隆保证方向性,单片段克隆的成功率超过95%。In-Fusion克隆的快速和易用性以及结果的可靠性,使系统可轻松应对高通量的工作流程。
实验案例
【数据提供】Jared L. Spidel, Morphotek, Inc.*
【客户感言】
“使用In-Fusion的阳性克隆率始终高于我们使用传统的酶切连接法,这使我们能够通过省略转化后涂板的步骤来简化我们的工艺流程并提高产量。由于大多数质粒都含有插入片段,我们可以将转化的细菌培养成库并直接进行小量制备。”——Jared L. Spidel,Morphotek,Inc.
【实验方法】
通过RT-PCR以从B细胞分离的RNA为模板扩增可变区(V)的cDNA,其中引物在5'末端含有15 bp与信号序列或恒定区(C)同源的序列。使用In-Fusion HD克隆将V区cDNA插入片段克隆到其C区线性化载体中。转化后,每个转化产物取50 μl加入到含1 ml TB的96-well深孔板中摇动培养过夜。对培养物进行质粒提取,并进行DNA测序以确认所需插入片段的存在。为了确定In-Fusion克隆的效率,将甘油菌种划线并进行菌落PCR。
【实验流程详解】
以下工作流程图只是说明In-Fusion技术如何通过手动或自动化平台扩展到96孔板进行克隆的一个基本示例,尽管这个流程包括我们推荐的转化细胞涂板以确保克隆数量的步骤,但在实际研究中,Morphotek公司的研究人员发现他们能够完全省略这一步骤。凭借In-Fusion Cloning的高准确度,他们开发了属于自己的抗体快速生产高通量流程,通过另一种培养方法进一步简化了操作步骤(Spidel, J.L. et al. 2016)。

Spidel和他的同事也评估过其他的克隆方法,之所以选择In-Fusion主要是看重了它的易用性和高阳性克隆率,这些都明显优于传统的酶切连接法。借助In-Fusion技术,他们还可以实现无缝克隆,这是他们用其他克隆无法做到的。
在实验过程中他们注意到,In-Fusion方法所具备的很高的克隆效率和“很少甚至没有背景”的特点,使他们能够完全省略转化后的涂板步骤,直接培养转化物得到半克隆库。因为通常情况下,筛选单个重组克隆是克隆实验中最耗时的部分,而In-Fusion技术使他们相信他们正在进行正确的克隆,这样就可以避免工作流程中的一大瓶颈,但这种方法并不适用于传统的酶切连接克隆,因为酶切效率低并且需要额外的DNA操作步骤。Spidel也验证了这种直接培养转化物的方法,以确保他们实验结果的准确性。
【参考文献】
Spidel, Jared L., et al. Rapid high-throughput cloning and stable expression of antibodies in HEK293 cells. Journal of Immunological Methods 439 (2016).
*以上内容为Jared Spidel提供,仅代表个人观点,不代表Morphotek, Inc.或Eisai Inc.。Takara Bio并没有因以上内容为Jared Spidel支付报酬。
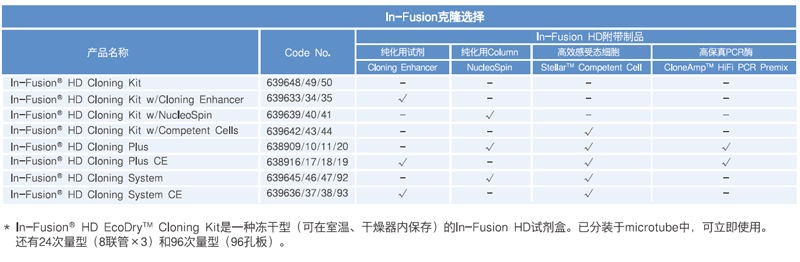
产品信息:
 |
