
实现特异、高效的 基因敲入(knockins)!
有效提高CRISPR/Cas9长链DNA敲入效率!
· 制备长达5 kb的长单链DNA(ssDNA)供体模板
· 三步操作,简便快速
· 不存在随机整合或者表达,提高了基因编辑效率
· 单链DNA(ssDNA)供体模板对细胞的毒性要远低于双链DNA(dsDNA)模板
CRISPR/Cas9和其它基因编辑工具已经被成功应用于获得基因敲除突变(knockout),但众多事实证明在基因敲入上的应用有很大的难度。基因敲入所面临的主要难题是修复模板的制备和如何与Cas9-sgRNA核糖核蛋白复合物共导入至细胞。虽然单链DNA(ssDNA)修复模板展示出了优于双链DNA(dsDNA)模板的众多优势,但是其制备难度和制备费用都有很大的挑战性,因而限制了长单链DNA(long ssDNA)模板的应用。Guide-it Long ssDNA Strandase Kit可以很好地解决这个矛盾,可制备长达5 kb的ssDNA寡核苷酸,应用于CRISPR/Cas9或者其它基因编辑技术作为基因敲入实验修复模板。本试剂盒提供了一种简便的方法通过有选择地消化降解双链DNA PCR产物的正义链(sense strand)或者反义链(antisense strand),将其转化为单链DNA。该试剂盒提供了可以制备50条ssDNA链的足量试剂(25对正义链和反义链)。
★ 以单链DNA作为修复模板的优势:
- 显著降低基因组随机整合的概率,提高基因编辑效率
- 导入ssDNA模板所产生的细胞毒性低
- 未整合的模板不能正常表达,这样更容易识别筛选目的细胞克隆
若您的实验中遇到以下问题推荐:荧光标记、LoxP位点、表达框、启动子、SNPs、抑制子、长链DNA、敲入效率低,采用本系统可有效提高您的实验效率!
■ 操作流程概览
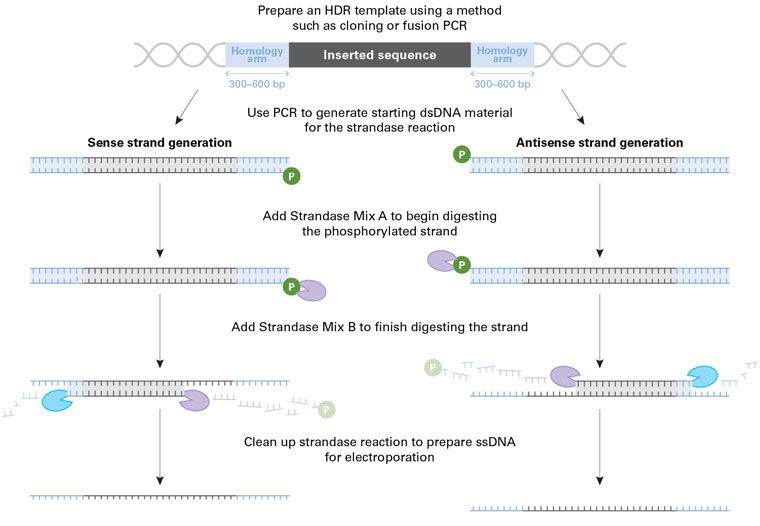
(图片来源于Takara Bio USA, Inc.)
同源定向修复(Homology Directed Repair)实验用长单链DNA(long ssDNA)供体模板制备步骤示意图。
第一步,通过合适的方法(克隆,融合PCR等)制作dsDNA起始模板,dsDNA模板包含与目的插入位点两侧同源的同源臂,模板中间是欲knockin的外源序列。
第二步,通过在第一步中产生的dsDNA的不同位置上结合磷酸化的引物,制备出两种不同的dsDNA作为Strandase反应的底物。添加Strandase Mix A,开始消化降解正义链或反义链(Strandase Mix A有选择性地降解磷酸化的DNA链)。
第三步,添加Strandase Mix B完成降解反应,从而获得ssDNA。最后,纯化ssDNA产物用于knockin实验。我们建议制备ssDNA正义链和ssDNA反义链并独立用于knockin实验。
■ 实验例:在GAPDH基因C端敲入AcGFP1,用于荧光标记HEK293细胞内源性GAPDH
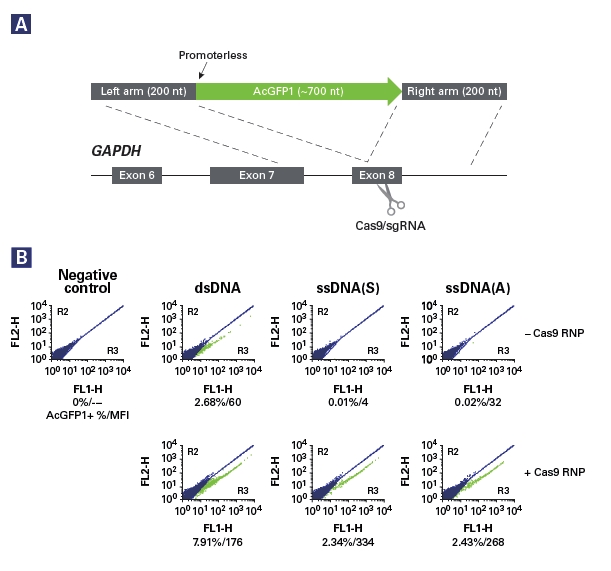
图A 采用Guide-it™ Long ssDNA Production System 制备长ssDNA供体模板,所设计的HDR供体模板的同源臂序列为GAPDH外显子8的末端序列,AcGFP1与 GAPDH处于同一阅读框。
图B 通过流式细胞术比较分析以dsDNA和ssDNA分别作为修复模板的实验结果。结果显示,当以dsDNA作为修复模板时,即使没有Cas9 RNPs,仍然出现相当多的带有绿色荧光的细胞克隆。当以长ssDNA正义链或者反义链作为修复模板时,只有同时加入Cas9和sgRNA,才会发生整合反应;而当没有Cas9 RNPs时,则没有检测到荧光背景,说明不发生整合反应。
Guide-it™ Long ssDNA Production System Clontech Guide-it™基因编辑 |
 |
