10X Genomics 单细胞 RNA-Seq

产品介绍
单细胞RNA测序技术概述
目前高通量测序技术已经深入到人类疾病、物种进化、动植物分子育种等传统的生物学研究领域中,逐渐成为一种不可或缺的研究工具。然而随着生命科学和医学基础研究的深入发展,人们发现越来越多的特殊标本和特定的生物学现象,如法医鉴定的微量标本、肿瘤内部异质性等无法用常规组织测序的方法进行研究。单细胞测序技术的出现,给这类样本的研究带来了极大的便利。
单细胞测序技术经过了10余年的发展,取得了众多的技术进展与突破。其中,单细胞RNA测序技术中,Smart-Seq方法以其可实现完整mRNA扩增的优势,被广泛的应用。而近期广受关注的另外一个高通量单细胞RNA测序技术由Macosko E团队开发,其研究成果于2015年发表在《Cell》杂志上,该技术结合了微流控液滴法,磁珠对细胞进行标记,可一次性完成多至一百万个细胞分离和扩增建库,这个技术的出现大幅的降低了单细胞RNA测序的成本,使得单细胞RNA水平的研究得到了飞跃发展。
华大基因依托于这两个技术开发优化的相应单细胞RNA测序产品:单管单细胞RNA测序、高通量单细胞RNA-Seq 。其中,高通量单细胞RNA-Seq产品依托于Droplet技术(液滴法),可实现上万个单细胞的同时进行分离和建库,大幅的降低建库成本的同时实现全局性的组织细胞转录图谱。
技术原理
基于10X Genomics平台的高通量单细胞RNA-Seq技术是利用液滴法的原理,使用GemCode技术,通过控制微流体的进入,将带有barcode、UMI(Unique
Molecular Index,分子标签)、引物及酶的凝胶珠(Gel
Beads)与单细胞混合,从而实现大规模的单细胞分离,以及单细胞文库构建的技术。
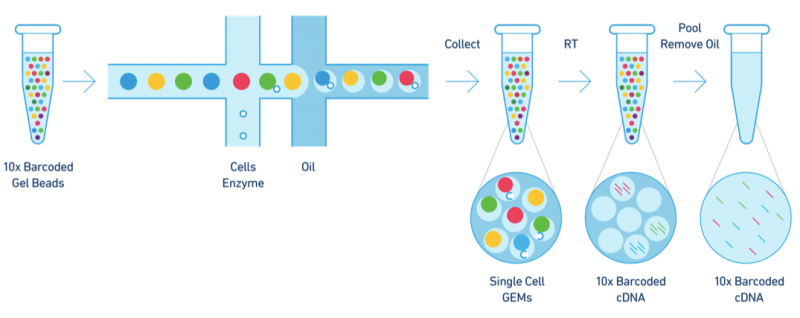
图1 10X Genomics技术原理示意图
10X Genomics平台的液滴封装大约有50%的捕获效率,可在6分钟内完成。分离完成后会形成一个GEM(Gel in Emulsion)的液滴结构,在这个液滴结构内,包含了一个凝胶珠,一套反应需要的试剂以及目标细胞,通过一套75万个barcode序列系统地对每个液滴进行唯一标记,随后上机测序,再利用信息分析的方法进行barcode序列的拆分,可实现一次100-10000个细胞的分离和文库构建。
实验流程
首先将样本制备成单细胞悬液,随后进行上机前细胞计数和细胞活率检测,若细胞活率≥80%,则将细胞浓度调整为700-1200个/μL。将制备好的细胞悬浮液利用微流控芯片,将带有细胞标签序列(cell Barcode)的凝胶珠(bead)和细胞包裹在液滴中。在液滴中,细胞破裂,释放的mRNA与凝胶珠上的细胞标签序列相连,形成单细胞GEMs结构(Gel
Bead in Emulsions)。细胞的mRNA在液滴中进行逆转录反应形成cDNA,随后破乳,进行 cDNA 的文库构建。通过文库序列上的细胞标签序列可以区分目标序列来自于哪一个细胞。
细胞和反应试剂在微流控芯片上的一条通道中,凝胶珠在另一条通道,共同形成GEM。在每个GEM中独立进行反转录,之后带有标签的 cDNA 将被混合然后扩增再进行文库构建。
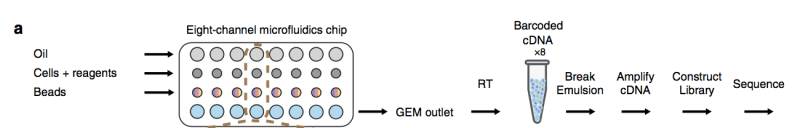
图2 GemCode平台单细胞RNA-Seq工作流程图
测序策略
测序平台:BGISEQ平台
测序读长:PE100
信息分析流程
测序得到的原始数据我们称之为Raw reads,之后我们会根据10X Genomics单细胞RNA-Seq独特的文库结构,对Reads的Barcode 、 UMI 和插入片段部分进行拆分,之后插入片段部分将比对到参考基因组,然后统计比对到各个区域的比例,并进行表达量统计;基于表达量的结果,进行细胞时间轨迹预测,细胞聚类等分析,基于差异表达的结果,进行KEGG富集,GO富集,蛋白互作网络分析等。
表1 信息分析内容
| 信息分析条款 |
信息分析内容 |
| 标准信息分析
(需要基于良好的参考序列,且每个样本拆分出的细胞数目上下浮动在20%,或以内的误差皆属于正常范围)
|
1. 测序结果统计
2. 数据质控统计
3. 比对结果统计
4. 基因表达定量分析
5. Marker基因鉴定
6. 细胞类型注释
7. 单样本/多样本细胞聚类分析
8. 特异marker基因差异分析
9. 样本间相同cluster基因差异分析
10. cluster差异表达基因GO功能分析
11. cluster差异表达基因Pathway功能分析
12. cluster差异表达基因TF编码能力预测
13. cluster差异表达基因蛋白互作分析
14. cluster基因相关性网络分析 |
| 高级信息分析 |
细胞轨迹分析(仅选取时间点样本可选做) |
| 定制化信息分析 |
可结合客户的需求,协商确定定制化信息分析内容。 |
案例解析
大规模单细胞并行的数字化转录图谱绘制
Massively
parallel digital transcriptional profiling of single cells
杂志: Nature
Communications
影响因子: 12.124
细胞类型:外周血单核细胞
研究内容:
对移植病人中分离出的骨髓单核细胞的转录图谱进行分析,比较捐献者与被捐献者的嵌合情况。通过进行单细胞RNA-Seq的分析可以实时监测急性髓性白血病人移植后,以及捐献者的免疫细胞和受捐献者的细胞之间的动态变化。文章一共进行29个样本的单细胞RNA-Seq,合计250,000个细胞。并对68,000的外周血单核细胞进行转录图谱绘制,进行免疫细胞亚群的系统性分类。找到主要的细胞亚群同时,发现了新细胞亚群(0.3% & 0.5%) ,以及对细胞亚群二级关系划分。
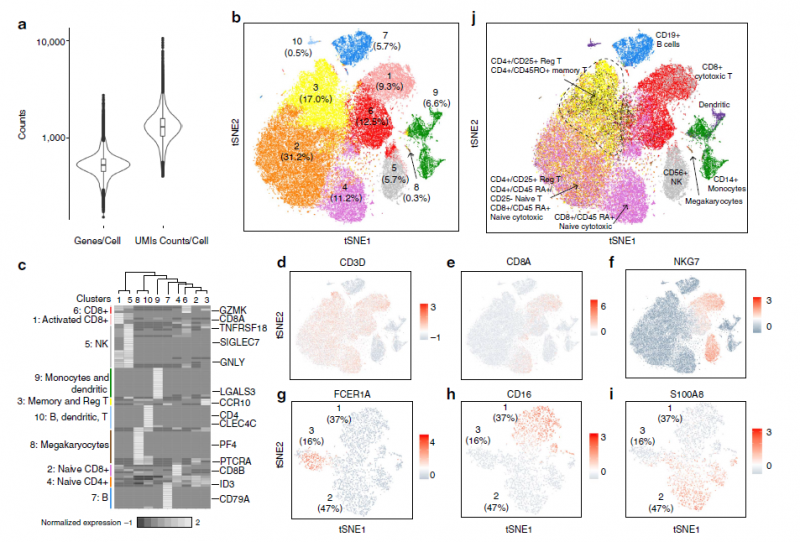
图1: 68,000个细胞的高通量单细胞RNA-Seq,可以清晰的被分成不同功能的细胞亚群
(a)整体细胞的表达量及细胞数中位数分析。(b)t-SNE细胞亚群聚类分析。(c)不同关键基因的表达量热图分析。(d)基于不同关键基因的细胞亚群聚类及表达量丰度分析。
通过对这些临床病例的外周血单核细胞进行大规模的单细胞RNA-Seq,可以观察到细胞亚群的组成比例,以及在HSCT(Hematopoietic
Stem Cell Transplantation)患者的骨髓中可能存在的残留病灶情况,这弥补了常规临床治疗中对这一部分信息的缺失。
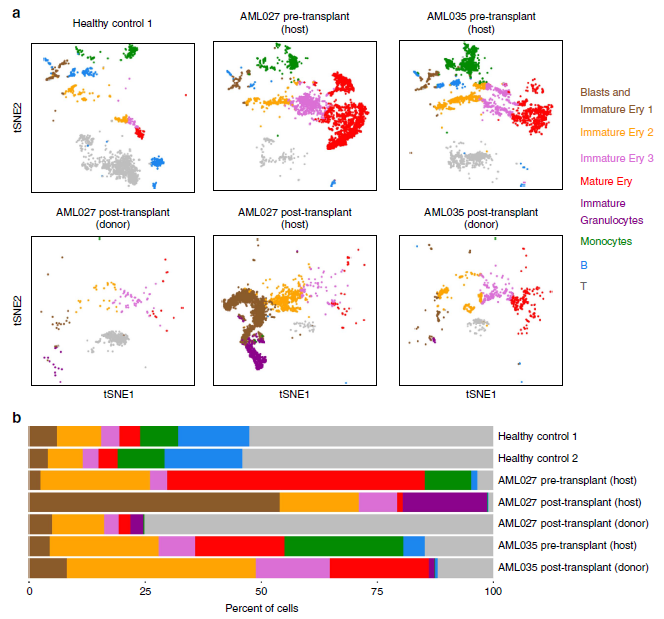
图2 移植后骨髓单核细胞的基因型以及对应的单细胞表达谱分析
(a) 通过tSNE projection分析软件对病人移植前和移植后的细胞进行二维聚类,每个点为一个细胞,不同的颜色表示其所属于不同的细胞亚群。(b)表示了不同的样本中,细胞亚群的比例情况。
结果展示
1、细胞亚群分类
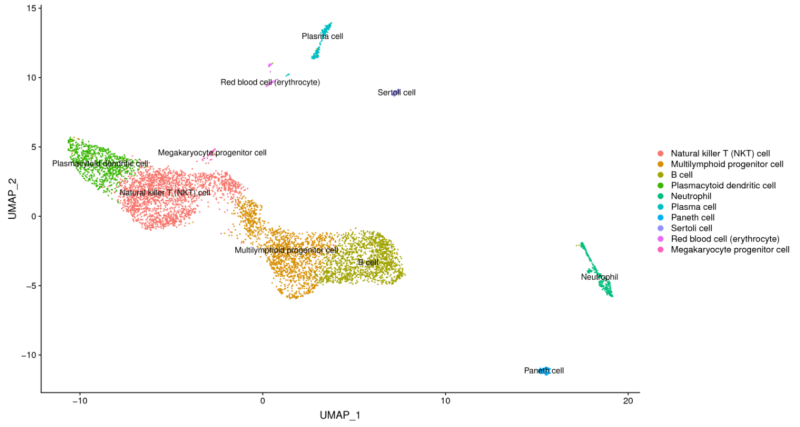
图1 细胞分类注释图
2、特异marker基因分析

图2 cluster特异marker基因小提琴图
3、样本间cluster差异表达基因分析
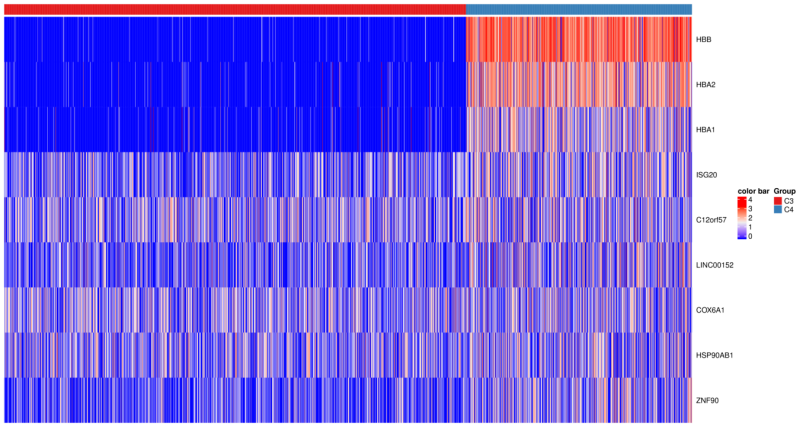
图3 样品间不同细胞类型差异基因点阵热图
根据选定的显著9个基因进行表达量热图展示
4、样本间相同cluster基因差异基因分析
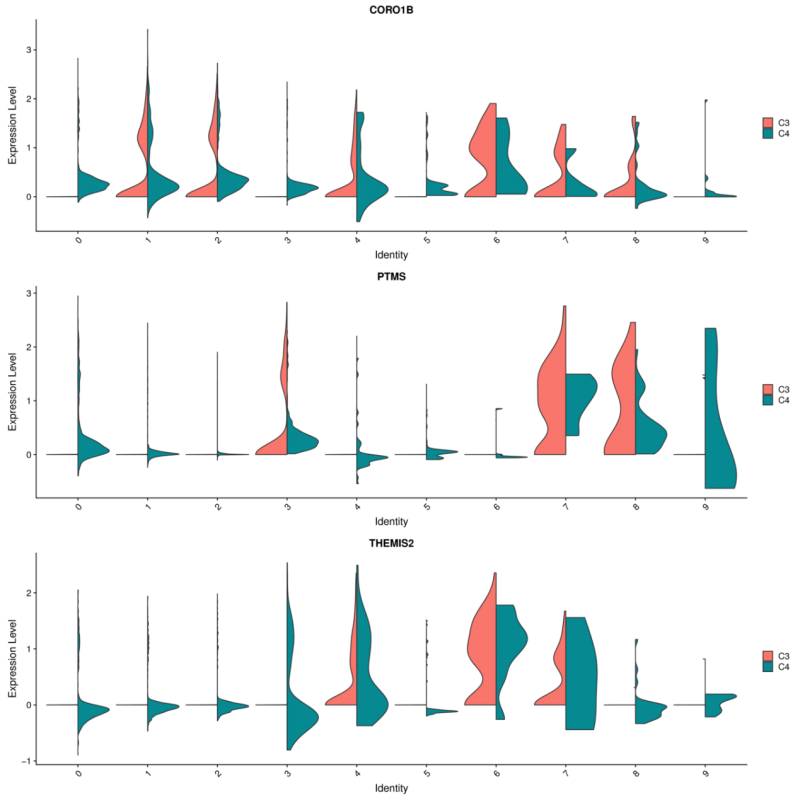
图4 样品间相同细胞类型差异基因小提琴图
横坐标表示细胞类型,纵坐标表示表达百分比
送样建议
细胞状态
|
细胞直径<40μm;细胞活性>80%;细胞浓度>5×105/ml
|
细胞悬液背景干净,无大量结团、碎片及杂质,不含Ca2+和Mg2+
|
常见问题
Q1:通过10X Genomics平台进行单细胞RNA-Seq的组织样品,是否可以提供前期处理的方法?
目前华大基因《单细胞送样建议手册》上有提供通用的组织消化方法可供参考,同时不同组织存在组织及细胞的特异性,使用通用组织消化方法的效率会因组织类型差异,存在消化效率的差异。
Q2:冻存细胞/组织样本寄送前有哪些注意事项?
需要提前与当地销售经理沟通,提前告知邮寄到样时间,加快实验进程以及确保细胞样本活性。
Q3:癌症组织样本可以协助解离服务和上门建库服务吗?
可以进行癌症组织样本组织解离服务和上门建库服务。
Q4:请问10X
Genomics单细胞RNA-Seq可以进行可变剪切等结构变化分析吗?
10X Genomics单细胞RNA-Seq产品主要定位为基因表达定量分析为主,数据不建议进行可变剪切等基因结构变化分析。如需研究结构变异信息,可进行单管单细胞RNA测序。
Q5:10X Genomics单细胞RNA-Seq采用的3’端扩增技术与Smart-seq2的扩增技术有什么区别?
Smart-seq2扩增技术针对是的3’~5’端全部的mRNA;3’端扩增技术主要是扩增3’端,是否能延伸至5’端,取决于酶的活性等系列实验因素决定。因此,扩增产物的长度上会有一定的区别和差异。
Q6:如果客户现场分离了1000个细胞,并检测出细胞活度很高,问:可否直接使用1000个细胞进行10X Genomics平台上机?
不建议。因为10X
Genomics单细胞RNA-Seq最低建议细胞送样量为106个细胞,且活率建议在85%以上。
Q7:细胞物种没有相应的参考基因组,可以做这个产品吗?
产品分析需要基于一个良好注释和组装的参考序列。基因注释不完善或只注释到转录本,没有注释到基因等的不完善参考序列,会出现占用内存过多,即使对转录本进行去冗余及重新构建,跑出的结果可能会不太好,需要客户明确其风险因素。
|