
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Nature Chemical Biology | 中国科大解码HSF1温度依赖性相分离机制
【字体: 大 中 小 】 时间:2025年01月11日 来源:中国科学技术大学 | 生命科学与医学部
编辑推荐:
2025 年 1 月 10 日,中国科学技术大学 项晟祺 教授课题组、 侯中怀 教授课题组和 姚雪彪 教授课题组在 Nature Chemical Biology 在线发表了题为“ The molecular mechanism of temperature-dependent phase separation of heat shock factor 1 ” 的研究论文
2025年1月10日,中国科学技术大学项晟祺教授课题组、侯中怀教授课题组和姚雪彪教授课题组在Nature Chemical Biology在线发表了题为“The molecular mechanism of temperature-dependent phase separation of heat shock factor 1”的研究论文。该研究首次发现了HSF1通过相分离传导温度调控效应。研究团队综合利用生物化学、核磁共振波谱学、统计物理和分子动力学模拟等多学科手段,成功解析了HSF1编码温度响应能力的化学代码,阐明了翻译后修饰对其活性的调控机制,并揭示了不同物种HSF1序列差异与其生理体温之间的关联。这一突破性发现为理解HSF1在生理与病理状态下的温度感知机制提供了全新的分子视角。

本研究率先揭示了HSF1具有温度依赖性相分离特征, 并发现不同物种HSF1的相变临界温度与其各自的生理体温高度一致,表明HSF1本身可作为就一个细胞内的天然“温度计”。研究进一步鉴定出HSF1中的天然无序区域——调节结构域(RD)是其感知温度和驱动相分离发生的核心功能模块,而相邻的亮氨酸拉链结构域主要发挥调节作用。RD内不同的翻译后修饰可显著改变其相分离行为。平均场模型对相图的拟合分析显示,野生型HSF1具有典型的低临界溶液温度(LCST)相分离特征。
为获取高分辨率的分子间相互作用细节,研究团队创新性地开发了一种基于核磁共振(NMR)数据驱动的粗粒化模拟力场优化方法。与传统力场相比,该优化力场能够更精确地捕捉少量突变引起的微小序列差异对无序蛋白构象及相分离行为的影响,实现了实验观测与理论模拟的深度融合。通过整合NMR实验与粗粒化分子动力学模拟,研究人员在残基水平上成功鉴定了驱动蛋白相分离的关键相互作用区域,并揭示了该区域在温度感知中的核心作用。
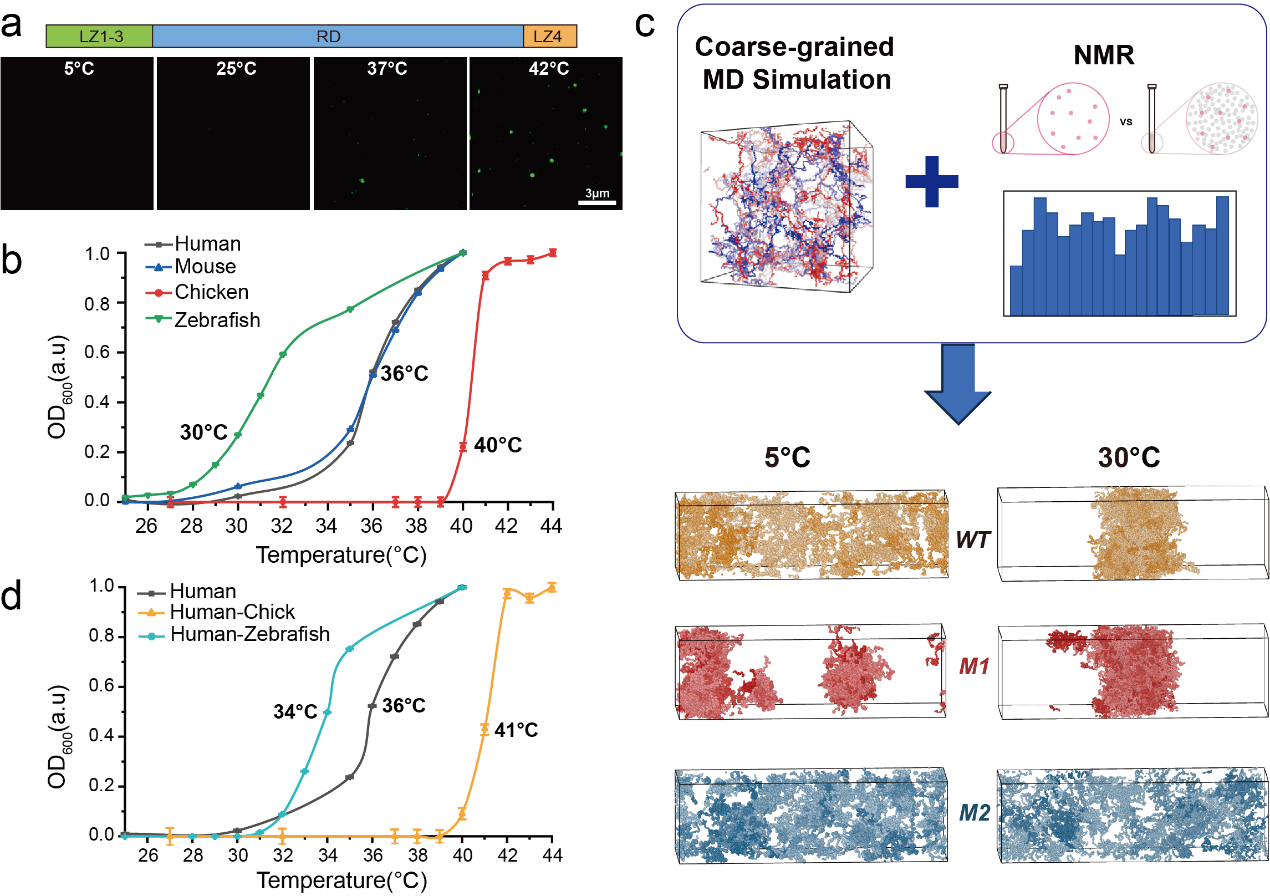
图1 a) HSF1有温度依赖性的相分离。b) 几个代表性物种的HSF1相变温度都在其生理体温附近。c)NMR互作数据驱动的粗粒化模拟方法,可以重现野生型及其模拟不同PTMs模式突变体的相分离现象。d) 交换不同物种HSF1的关键区域也改变了它们的相变温度。
本研究开创性地揭示了HSF1相分离与动物体温调控之间的内在联系,为深入理解HSF1在热休克反应中的分子机制提供了全新视角。这一重要发现不仅拓展了我们对蛋白质相分离生物学功能的认识,更为开发基于HSF1调控的新型治疗策略奠定了重要的理论基础,对治疗癌症、神经退行性疾病等与HSF1活性异常相关的疾病具有重要的指导意义。特别值得指出的是,本研究所建立的创新性研究方法为无序蛋白相分离的模拟研究提供了可靠的技术平台,可广泛应用于相关领域的研究,具有重要的方法论价值。这些研究成果将有力推动蛋白质相分离领域的发展,并为相关疾病的治疗提供新的思路和方向。
项晟祺课题组博士生任秋楠和侯中怀课题组博士生李林格为该论文的共同第一作者。项晟祺教授、姚雪彪教授和侯中怀教授为该论文的共同通讯作者。李娟博士,硕士研究生刘雷,史朝为研究员,国家蛋白质科学研究(上海)设施BL19U2生物小角散射线站的刘广峰博士,以及北京大学孙育杰教授均为该工作提供了重要帮助。
该工作得到无膜细胞器与细胞动力学教育部重点实验室和合肥微尺度国家研究中心的大力支持。得到国家自然科学基金、国家重点研发计划、中科院战略重点研究计划和中科院青年团队等项目的资助。
原文链接:https://www.nature.com/articles/s41589-024-01806-y