
-

生物通官微
陪你抓住生命科技
跳动的脉搏
eLife | 刘聪与合作者揭示乙酰化修饰在调控帕金森病致病蛋白α-s...
【字体: 大 中 小 】 时间:2025年01月03日 来源:中国科学院生物与化学交叉研究中心
编辑推荐:
近期, 中国科学院 生物与化学交叉研究中心刘聪课题组和美国辛辛那提大学医学院刁佳杰课题组在 eLife 上合作发表了一篇题为 “N-acetylation of α-synuclein enhances synaptic vesicle clustering mediated by α-synuclein and lysophosphatidylcholine” 的研究论文
α-突触核蛋白(α-synuclein, α-syn)是一类在神经元突触中高度富集的蛋白质,它通过与突触小泡互作调控其动态聚簇,进而调节神经递质释放,在神经信号传递中发挥重要作用。在病理条件下,α-syn自身发生异常聚集,其与帕金森病的发生发展密切相关。α-Syn存在多种翻译后修饰,如磷酸化,泛素化及乙酰化。相比于大量聚焦在不同的翻译后修饰调控α-syn的病理毒性的研究,对于化学修饰如何调控α-syn生理功能的研究较少。
近期,中国科学院生物与化学交叉研究中心刘聪课题组和美国辛辛那提大学医学院刁佳杰课题组在 eLife 上合作发表了一篇题为“N-acetylation of α-synuclein enhances synaptic vesicle clustering mediated by α-synuclein and lysophosphatidylcholine”的研究论文。该研究首次在分子水平上揭示了N端乙酰化如何通过调控α-syn与溶血磷脂的相互作用,增强其突触小泡聚集功能。这一发现不仅加深了我们对α-syn生理功能的理解,还提示N端乙酰化可能成为干预α-syn病理过程的重要切入点,为开发新型帕金森病治疗药物提供了新的可能方向。

在该工作中,研究团队首先制备了N端乙酰化的α-syn (Ac-α-syn) 和未修饰的α-syn (Un-α-syn) ,通过动态光散射和透射电子显微镜技术掲示Ac-α-syn在促进突触小泡聚集方面的效率显著高于Un-α-syn。通过模拟突触小泡膜的脂质体实验,研究人员发现对比于Un-α-syn, Ac-α-syn与溶血磷脂酰胆碱(lysophosphatidylcholine, LPC) 的结合能力显著增强,而对带负电荷的磷脂酰丝氨酸 (DOPS) 的结合效果无显著改变。进一步分析表明,LPC通过与Ac-α-syn的特异性相互作用促进了突触小泡的聚簇能力。利用高分辨率液态核磁技术,研究人员发现N端乙酰化可以通过中和N端正电荷提高Ac-α-syn插入脂质膜的能力,从而增强了与LPC的亲和力 (图1) 。这种修饰进一步促进了蛋白分子间的相互作用,形成稳定的聚集核心结构。该工作强调了翻译后修饰和脂质环境在调控α-syn生理功能中的重要性,进一步研究脂质环境的变化如何影响Ac-α-syn的行为可能为相应的神经退行性疾病的致病分子机制研究提供新方向。
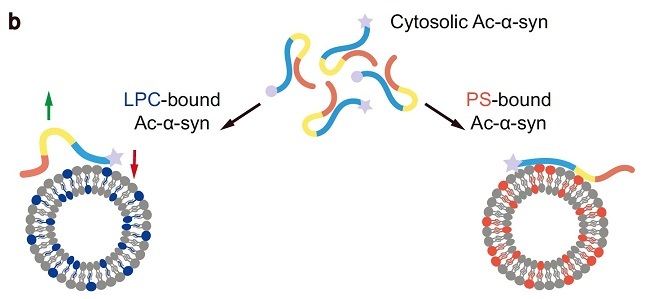
图 1. Ac-α-syn和LPC(左)、DOPS(右)脂质体结合的分子构象变化示意图
该研究由刘聪课题组和美国辛辛那提大学医学院刁佳杰课题组合作共同完成,刘聪研究员和刁佳杰教授为本文的共同通讯作者,中国科学院生物与化学交叉研究中心博士王楚楚和赵春雨为文章的共同第一作者。该工作得到了来自于国家自然科学基金委、科技部、上海市科委等项目基金及国际合作伙伴共同资助。
原文链接:https://elifesciences.org/articles/97228