
-

生物通官微
陪你抓住生命科技
跳动的脉搏
广州健康院揭示Sin3 HDAC Rpd3S核小体去乙酰化的结构基础
【字体: 大 中 小 】 时间:2024年12月19日 来源:中国科学院广州生物医药与健康研究院
编辑推荐:
近期,中国科学院广州生物医药与健康研究院与澳门大学合作发表研究论文Structural basis of nucleosome deacetylation and DNA linker tightening by Rpd3S histone deacetylase complex(组蛋白去乙酰化酶Rpd3S核小体去乙酰化和DNA linker收紧的分子机制),被Cell Research(IF=44.1)选为“近三年最顶级文章(Top articles from the past 3 years)”
近期,中国科学院广州生物医药与健康研究院与澳门大学合作发表研究论文Structural basis of nucleosome deacetylation and DNA linker tightening by Rpd3S histone deacetylase complex(组蛋白去乙酰化酶Rpd3S核小体去乙酰化和DNA linker收紧的分子机制),被Cell Research(IF=44.1)选为“近三年最顶级文章(Top articles from the past 3 years)”。组蛋白去乙酰化酶(Histone deacetylation, HDAC)领域的开创性人物Jerry L. Workman以研究亮点(Research Highlight)的形式点评和讨论了该论文研究内容。以上报道充分肯定了该项研究内容的创新性及重要性,该论文揭示了Class I HDAC复合物发挥功能的结构与生化基础,将微观世界的酶活反应以蛋白质复合体剪影的形式呈现出来,彰显了大自然精巧的蛋白质结构设计和表观遗传调控的复杂性,为基于结构的靶向药物设计奠定了理论基础。
表观遗传调控是确保细胞表型多样性的关键机制,基因表达水平的失调与疾病的发生密切相关。在酿酒酵母中,组蛋白去乙酰化酶Rpd3作为抑制因子调控基因转录,参与形成Rpd3S(Small)和Rpd3L(Large)两种分子量约为0.6MDa和1.2MDa的大分子复合物来执行抑制基因转录的功能。人源Rpd3S复合物的功能异常与多种肿瘤的发生、发展密切相关,是乳腺癌、肺癌、急性髓细胞白血病、多发性骨髓瘤等实体瘤和血液系统恶性肿瘤重要的药物靶点,也被认为是抗肿瘤药物开发最有希望的靶点之一。HDAC抑制剂可以抑制肿瘤细胞增殖、阻滞细胞周期,进而诱导肿瘤细胞分化或凋亡,但由于缺乏对HDAC复合物的透彻研究,使得临床使用的非特异性HDAC抑制剂通常伴随着恶心、血小板减少和骨髓抑制等一系列不良反应。因此,Sin3 HDAC Rpd3S复合物核小体去乙酰化功能的分子机制的研究亟待开展且尤为重要,获取的结构和功能信息将会为基于蛋白质结构的特异性HDAC抑制剂的设计提供全新的视角和潜在的靶点。
研究团队结合生化实验与单颗粒冷冻电镜技术确定了Rpd3S组装模式,并且以多种不同核小体底物模拟Rpd3S去乙酰化过程中的不同状态,成功捕获了Rpd3S在H3K36甲基化依赖的去乙酰化过程中的多个构象,以及与Linker Histone H1共存的模式。基于以上研究结果提出了Rpd3S在不同H3K36me3和linkerDNA协作的条件下多个全新的结合模型,发现Rpd3S复合物各亚基的组装模式以及识别核小体底物的关键氨基酸位点,揭示了Rpd3S通过调整与核小体的相对位置实现对不同组蛋白去乙酰化的分子机制;同时,也发现了Rpd3S完成去乙酰化与Hho1发生时空伴随,可能是Rpd3S去乙酰化后移向+1核小体与Hho1协同参与组装和压缩染色质并进一步沉默基因转录。
中国科学院广州生物医药与健康研究院何俊研究员与澳门大学William Chong Hang Chao教授为本文的共同通讯作者。中国科学院广州生物医药与健康研究院博士生董淑琦、博士后Nadia?Rasheed,澳门大学博士后李华东、博士生王美林为本文共同第一作者。该研究得到了国家自然科学基金、中国科学院启动基金以及澳门大学、澳门特别行政区科学技术发展基金等的资助。
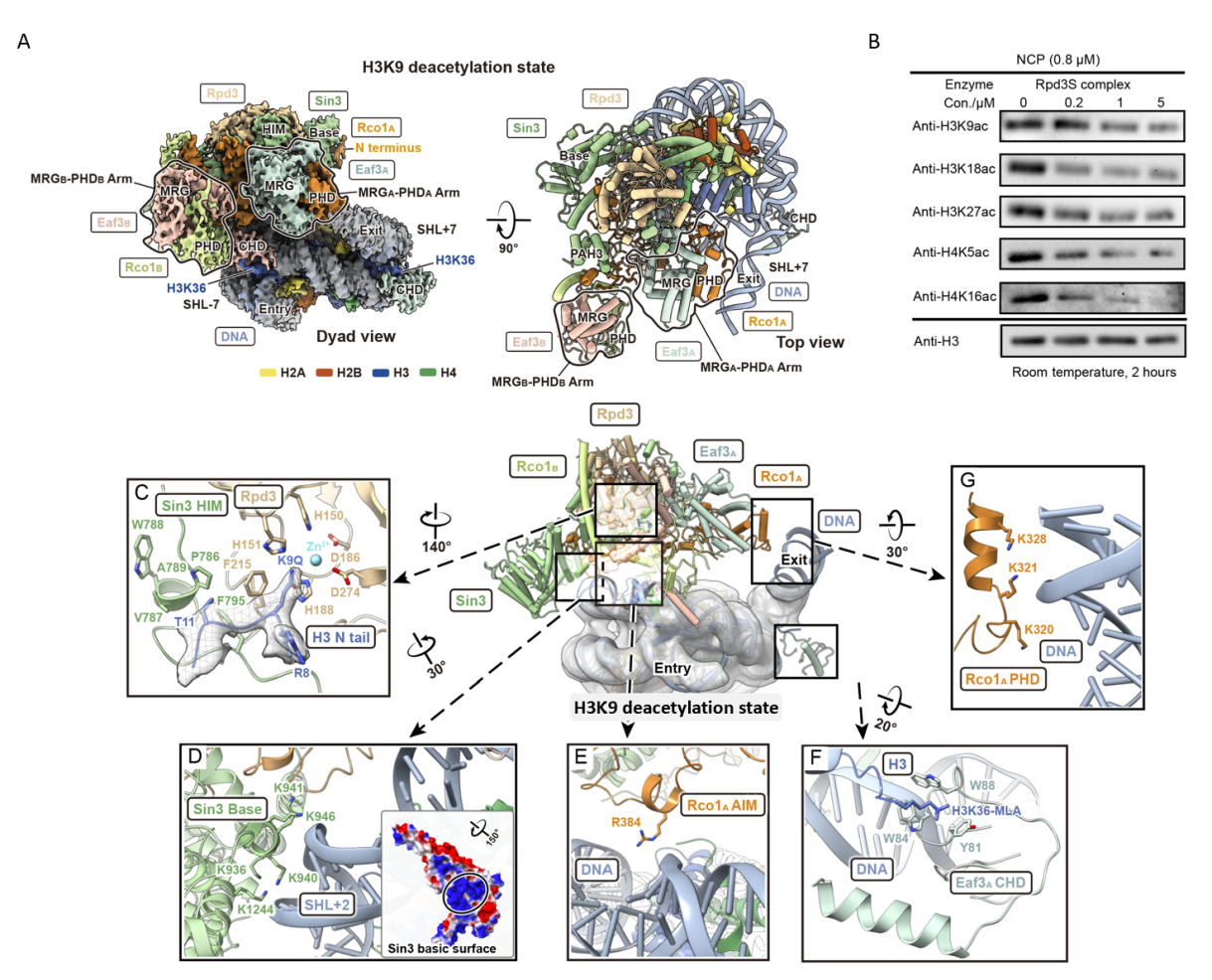
图1. A:Rpd3S去乙酰化H3K9的cryo-EM电子密度图及搭建模型图;B:Rpd3S去乙酰化H3/H4不同赖氨酸残基的western blotting结果;C:H3 N端K9Q与Rpd3的酶活中心相互作用图;D:Sin3 basic surface氨基酸与DNA相互作用图;E:Rco1 AIM与DNA相互作用图;F:CHD芳香笼与H3K36me3相互作用图;G:Rco1 PHD与DNA相互作用图。