
-

生物通官微
陪你抓住生命科技
跳动的脉搏
解云礼课题组揭示神经干细胞增殖分化调控新机制
【字体: 大 中 小 】 时间:2023年06月27日 来源:复旦大学脑科学研究院
哺乳动物大脑中有近千亿的神经元,它们组成了复杂的神经网络,是大脑行使高级功能的基础。然而,数量如此庞大的神经元却是由数量相对较少的神经干细胞在脑发育早期分化而来。因此,精确调控神经干细胞的增殖与分化是大脑中特定数量神经元发生的关键机制。
复旦大学脑科学研究院/医学神经生物学国家重点实验室解云礼课题组和生物医学研究院温文玉课题组合作,发现神经干细胞中极性蛋白通过相分离方式调控其增殖与分化,为深入理解大脑神经发生提供了新的见解。研究结果于2023年6月24日在线发表在Cell Reports杂志上。
胚胎脑中神经干细胞是一种高度极性化的细胞,胞体定位在脑室区(ventricular zone),通过顶端纤维(apical process)和基底纤维(basal process)分别连接着大脑皮质的脑室区和脑膜(pial surface)。早期研究发现位于顶端纤维末端的极性蛋白Par3对于神经干细胞的增殖与分化平衡具有重要作用,但具体机制不清楚。本研究利用生物化学等手段,我们首先鉴定了一个新的与Par3相互作用的极性蛋白Ccdc85c。进一步的研究发现,Ccdc85c与Par3相互作用有助于Par3自抑制构象的打开,并发生相分离进而能够招募更多的Notch信号抑制因子Numb,最终使得神经干细胞中的Notch信号通路能够维持在正常水平,确保神经干细胞实现增殖与分化的平衡。该研究解析了神经干细胞极性蛋白精确调控其增殖分化的分子机制,为深入了解大脑神经发生提供了新的见解。
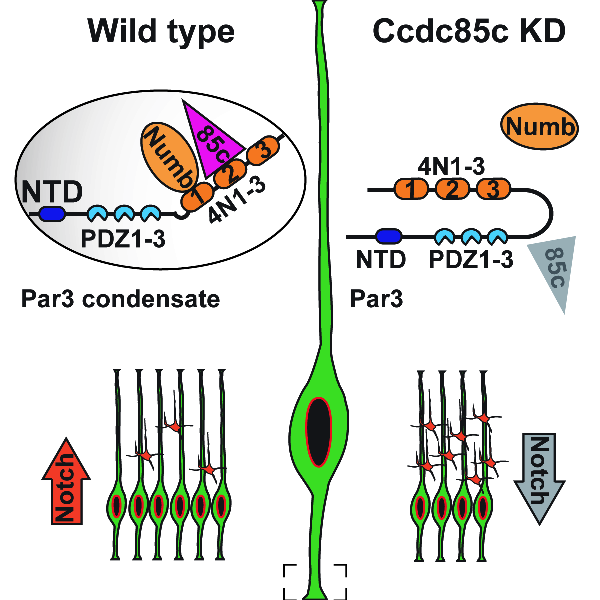
图注:Ccdc85c与Par3的结合有助于Par3募集Numb蛋白从而维持神经干细胞中的Notch信号通路水平。
复旦大学徐嘉文,邓鑫,顾爱红和蔡玉群为本文的共同第一作者,解云礼研究员和温文玉研究员为共同通讯作者。本研究得到了STI2030重大项目、国家重点研发计划项目、国家自然科学基金、上海市科技重大专项、张江实验室和上海脑科学与类脑技术中心的支持。
文章链接:https://doi.org/10.1016/j.celrep.2023.112677
涓嬭浇瀹夋嵎浼︾數瀛愪功銆婇€氳繃缁嗚優浠h阿鎻ず鏂扮殑鑽墿闈剁偣銆嬫帰绱㈠浣曢€氳繃浠h阿鍒嗘瀽淇冭繘鎮ㄧ殑鑽墿鍙戠幇鐮旂┒
10x Genomics鏂板搧Visium HD 寮€鍚崟缁嗚優鍒嗚鲸鐜囩殑鍏ㄨ浆褰曠粍绌洪棿鍒嗘瀽锛�
娆㈣繋涓嬭浇Twist銆婁笉鏂彉鍖栫殑CRISPR绛涢€夋牸灞€銆嬬數瀛愪功
 生物通微信公众号
生物通微信公众号
知名企业招聘
今日动态 | 人才市场 | 新技术专栏 | 中国科学人 | 云展台 | BioHot | 云讲堂直播 | 会展中心 | 特价专栏 | 技术快讯 | 免费试用
版权所有 生物通
Copyright© eBiotrade.com, All Rights Reserved
联系信箱:
粤ICP备09063491号
