
-

生物通官微
陪你抓住生命科技
跳动的脉搏
靶向STING的癌症免疫治疗研究进展
【字体: 大 中 小 】 时间:2023年04月28日 来源:现代医学前沿
编辑推荐:
近年来,越来越多的临床证据证实,ICIs肿瘤免疫治疗的有效性取决于肿瘤中已有的抗肿瘤T细胞应答,肿瘤中T细胞浸润与免疫治疗的预后呈正相关。T细胞反应的启动和维持依赖于先天免疫反应,这也是抗癌免疫的关键因素。
在过去的十年中,使用免疫检查点抑制剂的癌症免疫治疗在癌症治疗中取得了前所未有的成功;然而,只有一小部分(10-35%)的患者可以从这种治疗中获得临床益处,因此,迫切需要确定新的策略来提高免疫检查点抑制剂的临床疗效。近年来,越来越多的临床证据证实,ICIs肿瘤免疫治疗的有效性取决于肿瘤中已有的抗肿瘤T细胞应答,肿瘤中T细胞浸润与免疫治疗的预后呈正相关。T细胞反应的启动和维持依赖于先天免疫反应,这也是抗癌免疫的关键因素。
环状GMP-AMP合成酶(cGAS)-干扰素基因刺激因子(STING)信号通路作为一种先天细胞质DNA感知途径,因其激活先天免疫和适应性免疫,帮助宿主防御癌症而备受关注。基于cGAS-STING信号通路在抗癌免疫中的关键作用,各种STING激动剂被开发出来,并被证明是一种很有前途的癌症治疗策略。
先天免疫系统可以通过模式识别受体(包括cGAS)识别病原体或损伤相关模式。cGAS是细胞质双链DNA (dsDNA)的先天免疫传感器,具有催化结构域和两个主要的DNA结合位点。细胞质DNA,无论是外源的还是内源的,都可以通过其磷酸主链与cGAS带正电的位点之间的相互作用以序列无关的方式结合,形成2:2复合物。在与DNA结合后,cGAS在催化口袋中发生了实质性的构象变化,促进了cGAS的活化,从而促进了三磷酸腺苷(ATP)和三磷酸鸟苷(GTP)合成第二信使cGAMP。
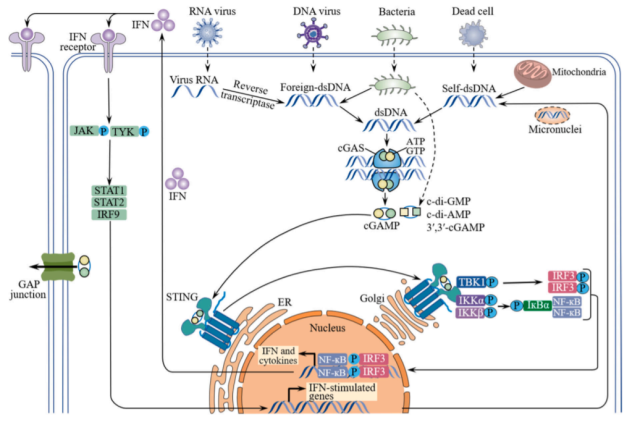
与cGAMP结合后,内质网(ER)结合的STING二聚体经历了从无活性开放形式到活性封闭形式的重大构象转变,并触发其从内质网到高尔基体的转运,在高尔基体中STING被招募,Tank-binding kinase 1 (TBK1)的磷酸化导致干扰素调节因子3 (IRF3)的募集。
IRF3被TBK1磷酸化后,二聚体进入细胞核,驱动I型干扰素的表达。新表达的I型干扰素通过与异二聚体受体IFNAR1/2结合,以自分泌和旁分泌的方式起作用,然后激活Janus激酶1 (JAK1)和酪氨酸激酶2 (TYK2),导致转录传感器和激活因子1 (STAT1)和STAT2的信号磷酸化。
STAT1/2异源二聚体结合IRF9并随后转运到细胞核,触发IFN刺激基因(ISGs)的转录。STING还在一定程度上募集i -κB激酶(IKK), IKK使核因子-κB (NF-κB)抑制剂i -κB α磷酸化,导致NF-κB易位至细胞核,进而表达IL-6、TNF等促炎细胞因子。
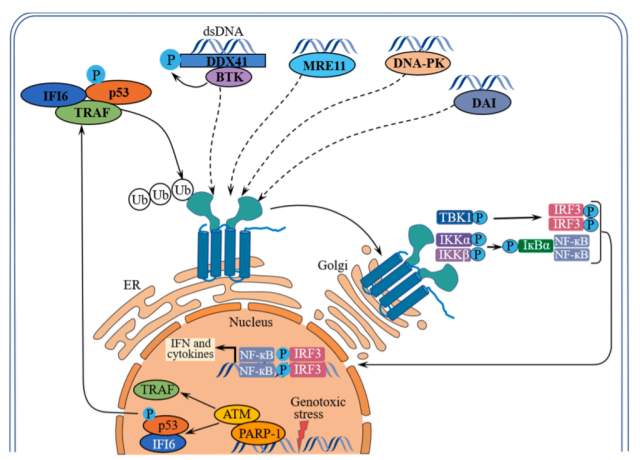
除cGAS外,STING信号通路的激活还可以通过其他DNA传感器介导,包括干扰素γ诱导蛋白16 (IFI16)、DEAD盒解旋酶41 (DDX41)、减数分裂重组11同源物A (MRE11)、DNA依赖性蛋白激酶(DNA- pk)和DNA依赖性IRF激活因子(DAI)。
研究表明,cGAS-STING信号通路参与了肿瘤免疫周期的不同阶段,激活这条细胞质DNA传感通路可通过多种方式促进肿瘤免疫周期。
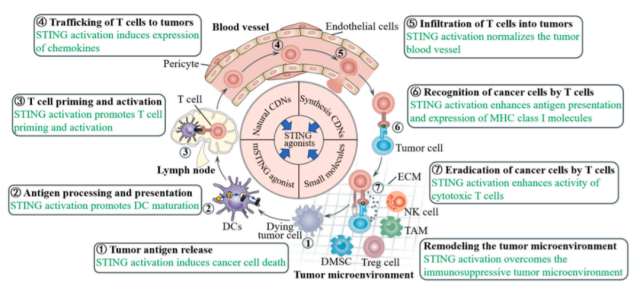
癌细胞固有的cGAS-STING信号通路对抗癌免疫很重要,因为癌细胞的细胞质DNA积累以cGAS-STING依赖的方式促进IFN-β的产生,从而抑制肿瘤生长并增强肿瘤对检查点阻断的抵抗力。
对检查点阻断的敏感性,而癌细胞中固有的cGAS-STING信号的丢失导致T细胞浸润减少和对检查点阻断的抵抗力增加。cGAS-STING信号通路已被发现在多种癌症中受到抑制,癌细胞内在cGAS/STING表达的下调也被证明与癌症患者临床预后不良相关。癌细胞中STING的激活有助于癌细胞死亡和诱导T细胞反应。
肿瘤微环境中肿瘤细胞来源的DNA也可以通过吞噬作用被DC吸收,随后激活cGAS-STING通路,促进I型IFN的产生,从而促进DC成熟并介导T细胞活化。
T细胞通常被认为是抗肿瘤免疫的主要参与者。然而,T细胞的启动和激活需要三个信号,包括主要组织相容性复合体上的肿瘤抗原(信号1)、共刺激分子(信号2)和某些促炎细胞因子(信号3)。所有这些信号都可以通过激活STING通路而增强。
T细胞从脉管系统外渗和迁移到肿瘤微环境是T细胞识别和随后消除肿瘤细胞的先决条件。STING通路的激活以多种方式促进T细胞运输和浸润到肿瘤中。
首先,树突状细胞中STING通路的激活促进了趋化因子CXCL9和CXCL10的表达,这两种趋化因子都以STING依赖的方式对T细胞转运到肿瘤中至关重要。
此外,在肿瘤内皮细胞中激活STING可上调内皮细胞上的粘附分子,如e -选择素、血管细胞粘附蛋白1 (VCAM-1)和整合素配体细胞间粘附分子1 (ICAM-1),增强T细胞从血管外渗。
在癌细胞中激活STING可以上调癌细胞上的MHC I类分子,改善肿瘤抗原的提呈,从而促进肿瘤抗原被细胞毒性T细胞识别和清除。
相反,STING信号通路的缺陷保护癌细胞免受细胞毒性T淋巴细胞的免疫识别,并限制其对细胞毒性T细胞裂解的易感性。此外,用激动剂激活STING可增强肿瘤中细胞毒性T细胞的浸润和活性,有助于诱导肿瘤消退。
免疫抑制性肿瘤相关免疫细胞,包括肿瘤相关巨噬细胞、髓源性抑制细胞(MDSCs)和调节性T细胞,已被证明可直接或间接抑制T细胞介导的免疫反应。
事实上,STING的激活不仅使肿瘤相关巨噬细胞向抗肿瘤的M1巨噬细胞极化,而且使M2巨噬细胞重编程为M1巨噬细胞。此外,STING激活抑制MDSCs的扩增和T细胞抑制,同时诱导MDSCs产生髓系归巢的趋化因子,从而抑制MDSCs的免疫抑制功能,将大量的单核细胞、巨噬细胞、募集的T细胞等免疫细胞定向到肿瘤部位。STING激动剂还能降低肿瘤微环境中调节性T细胞的水平。
STING信号在抗肿瘤免疫应答中的关键作用使其成为肿瘤免疫治疗的一个有吸引力的治疗靶点。
因此,学术界和制药行业对开发STING激动剂重新产生了兴趣。目前,已经报道了许多具有临床前益处的STING激动剂,其中一些已经进入临床试验。
随着cGAS-STING信号通路的分子机制越来越清晰,STING激动剂的开发重点放在了环二核苷酸(cyclic dinucleotide, CDNs)上,它们是STING的天然配体,如 c- diGMP、c-diAMP、3′,3′-cGAMP和2′,3′-cGAMP.
在临床前研究中,天然CDNs已显示出作为治疗性疫苗佐剂和免疫疗法的前景。
然而,天然CDNs的临床发展受到磷酸二酯酶的快速水解,细胞质递送差以及缺乏激活所有人类STING亚型的能力的限制。
由于天然CDNs在抗癌治疗中的不足,人们开始努力开发基于CDNs的合成STING激动剂,以提高其稳定性和治疗效果。
其中,ADU-S100 (MIW815)对小鼠和人STING的亲和力均高于未修饰的CDNs。经瘤内注射后,ADU-S100不仅能有效消除多种肿瘤类型,还能诱导出强大的CD8+ T细胞应答。
然而,在一项针对晚期/转移性癌症患者的I期研究(NCT02675439)中,ADU-S100作为单药治疗的临床活性有限,尽管ADU-S100被证明具有良好的耐受性并引发全身免疫激活。
除ADU-S100外,还设计了其他基于CDNs的STING激动剂。
MK-1454是默克公司开发的一种新型改性CDN。在体外,MK-1454对STING具有较高的亲和力,具有较强的诱导IFN-β分泌的能力。此外,在小鼠同基因肿瘤模型中,瘤内注射MK-1454可诱导肿瘤完全消退,增强抗pd1治疗的抗肿瘤作用。
一项正在进行的临床试验正在评估MK-1454联合派姆单抗治疗晚期实体瘤或淋巴瘤患者(NCT03010176)的安全性和有效性。初步数据表明,尽管MK-1454单药治疗无效,但MK-1454联合派姆单抗产生了令人鼓舞的疗效。
基于这些数据,MK-1454联合派姆单抗用于头颈部鳞状细胞癌患者的II期临床试验(NCT04220866)正在探索中,临床结果尚未公布。
此外,其他基于CDNs的STING激动剂,包括S B11285、BI1387446和IMSA101也正在进行临床评估。
与基于CDNs的STING激动剂相比,小分子STING激动剂具有药代动力学优越、化学合成简单等明显优势。因此,STING激动剂的开发重点已转向非CDNs衍生的小分子STING激动剂。
最近,葛兰素史克公司的科学家通过高通量筛选确定了一系列氨基苯并咪唑(ABZI)衍生物作为STING激动剂。
它们在人外周血单核细胞(PBMCs)中激活STING的能力是cGAMP的400倍,在小鼠外周血单核细胞中也显示出强大的STING激活能力。静脉给药显著抑制了结直肠癌小鼠的肿瘤生长,提高了存活率,80%的治疗小鼠在研究结束时达到了无肿瘤状态。
默克公司最近的一项研究报道,一种名为MSA-2的口服苯并噻吩类STING激动剂可触发TBK1和IRF-3的磷酸化,并以STING依赖的方式诱导人单核细胞THP。诱导-1细胞分泌IFN-β。
由于其低pKa, MSA-2在酸性肿瘤微环境中表现出比正常组织更高的细胞通透性和效力,这表明MSA-2可以选择性靶向肿瘤组织,适合全身给药,这比CDNs具有相对显著的优势。
MSA-2在MC38同基因肿瘤小鼠中表现出剂量依赖性的抗肿瘤活性,80%-100%的治疗小鼠肿瘤完全消退。
除了上面提到的小分子TING激动剂,还有几种未公开的小分子STING激动剂正在临床试验中。其中SNX281是一种新型STING激动剂,具有良好的药动学特性。
SNX281联合抗pd -1抗体在MC38、CT26和B16-F10等肿瘤模型中显示出显著的抗肿瘤活性和生存获益。目前,pembrolizumab作为单药和联合pembrolizumab用于晚期实体瘤和淋巴瘤(NCT04609579)的I期临床试验正在进行中。
此外,其他STING激动剂如TAK-676 (NCT04420884)、GSK3745417 (NCT05424380)和MK-2118 (NCT03249792)也正在I期试验中进行单药治疗和与抗pd -1抗体联合治疗的评估。
尽管在临床前和临床研究中已经证明了STING激动剂的治疗潜力,但其发展仍处于起步阶段,面临着严重的挑战,阻碍了其临床发展。
首先,STING激活在癌症免疫中是一把双刃剑。
STING的激活不仅可以促进T细胞的启动和激活,而且STING的激活还可以诱导PD-L1和IDO等免疫抑制分子的表达。
令人惊讶的是,长期暴露于高剂量的STING激动剂被发现会诱导T细胞凋亡,这与激动剂的预期作用完全相反,而低剂量的STING激动剂会引起强大的T细胞反应,并与免疫检查点抑制剂协同作用。
因此,为了获得最佳的STING激动剂抗肿瘤效果,有必要优化STING激动剂的剂量和给药时间,避免过度刺激和负调节。
其次,由于STING基因的单核苷酸多态性,人类存在5种主要的STING变异类型,分别是R232(57.9%)、HAQ(20.4%)、R232H(13.7%)、AQ(5.2%)和R293Q(1.5%)。这些人类STING变异体已被证明对STING激动剂有不同的反应。
此外,这些变体的分布在不同的种族群体中也有所不同,例如,HAQ变体在东亚人中很常见,但在非洲人中很少见。因此,在招募患者进行临床试验时,应考虑人群中STING变异的偏倚分布。
总体而言,人类STING基因在人群中具有较大的异质性和偏倚分布,这对STING激动剂的开发构成了障碍。
第三,STING在多种细胞类型中广泛表达,包括癌细胞和非癌细胞。目前,虽然已经开发出适合全身给药的STING激动剂,但几乎所有激动剂都缺乏肿瘤特异性(除了MSA-2)。
因此,全身给药STING激动剂有可能在全身不加区分地激活STING,从而诱导促炎细胞因子在肿瘤和非肿瘤组织中分泌,甚至引发细胞因子风暴。系统给药的STING激动剂应特异性靶向肿瘤组织,在肿瘤微环境中引发抗肿瘤免疫反应,从而最大限度地提高抗肿瘤效果,减轻对正常组织的副作用。
综上所述,cGAS-STING信号通路是一条重要的先天免疫通路,在肿瘤免疫监测中起着至关重要的作用。
STING激活已被证明可以促进癌症免疫周期,将免疫抑制的肿瘤微环境转变为免疫支持的微环境。
由于STING的免疫刺激作用,近年来开发了多种STING激动剂,目前有许多正在临床试验中。
然而,STING激动剂的发展仍面临许多挑战,包括STING信号的双重作用,以及STING的异质性和普遍表达。此外,我们对cGAS-STING信号通路的认识还有待提高。
例如,癌症中cGAS-STING信号抑制的机制目前尚不清楚。同样,STING激活如何诱导免疫抑制分子(包括PD-L1和IDO)的表达也尚未阐明。
这些挑战和未知将有助于推动对这一途径的持续研究,该领域的新发现将使STING激动剂在癌症免疫治疗中发挥更大的作用。
(本文来源网络)