编辑推荐:
2023年1月14日,中国科学院上海药物研究所谢欣研究团队在JHEP Reports发表题为“Small Molecule Drugs Promote Repopulation of Transplanted Hepatocytes by Stimulating Cell Dedifferentiation”的研究论文,报道了利用小分子药物促进移植肝细胞在体内增殖的新方法
肝移植是治疗终末期肝病唯一的方法,但能用于移植的肝脏非常有限,极大限制了肝移植的应用。肝细胞是肝脏内最主要的功能细胞,使用肝细胞移植替代肝移植是最有前景的研究方向之一。目前,肝细胞移植面临的最大障碍是移植细胞整合率较低、增殖率较差。因此,解析移植后肝细胞体内增殖的机制,并开发促移植后肝细胞体内增殖的方法尤为重要。
2023年1月14日,中国科学院上海药物研究所谢欣研究团队在JHEP Reports发表题为“Small Molecule Drugs Promote Repopulation of Transplanted Hepatocytes by Stimulating Cell Dedifferentiation”的研究论文,报道了利用小分子药物促进移植肝细胞在体内增殖的新方法。
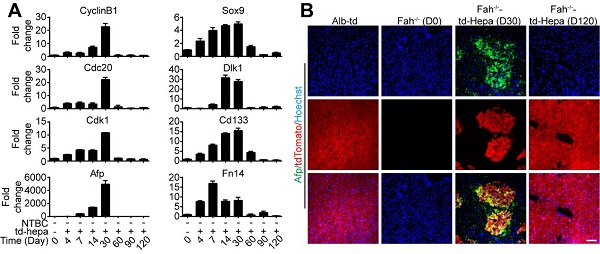
在此项研究中,研究人员通过分析肝细胞移植后在体内的增殖过程,发现移植的成熟肝细胞会首先去分化为肝祖细胞进行扩增,当增殖结束后会重新分化为成熟的肝细胞。肝细胞在体内的增殖能力与其肝祖细胞相关基因的表达水平有很强的相关性(图1)。研究人员猜想,若能促进移植肝细胞的去分化过程,将可能加速移植后肝细胞在体内的增殖。
图1. A, 荧光定量PCR分析Fah-/-小鼠在进行肝细胞移植后第0至120天,肝脏内细胞周期基因和肝祖细胞基因表达变化。B,肝祖细胞蛋白Afp在移植前,移植第30和120天的肝脏内的免疫荧光染色。
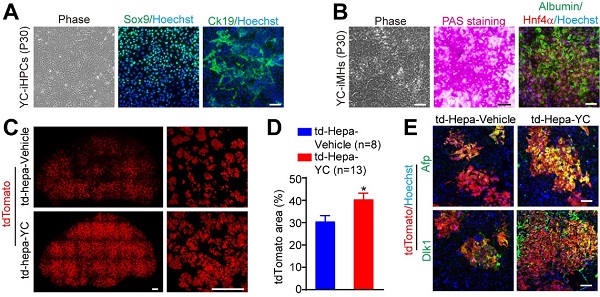
通过筛选,研究人员发现联用小分子化合物Y-27632(Y,Rock信号通路抑制剂)和CHIR99021(C,Wnt通路抑制剂)可以诱导肝细胞去分化为肝祖细胞(YC induced hepatic progenitor cells,YC-iHPCs)进行扩增,YC-iHPCs可以在体外连续传代30代以上,并一直具有分化为成熟肝细胞(YC induced mature hepatocytes, YC-iMHs)的能力(图2)。进一步的体内实验表明,联用YC可以促进移植后肝细胞在体内去分化为肝祖细胞,并可以加速移植后肝细胞的体内增殖(图2)。Netarsudil (N) 和 LY2090314 (L), 两个进入过临床研究的小分子药物,同样靶向上述两条通路,他们在体外及体内具有与YC类似的促肝细胞增殖作用。
图2. A,YC-iHPCs传代到第30代的形态图,肝祖蛋白Sox9和Ck19的免疫荧光染色。B,YC-iMHs (P30)的形态,PAS染色及Albumin/Hnf4?的免疫荧光染色。C,给与Fah-/-小鼠YC处理可以促进移植肝细胞在Fah-/-小鼠肝脏中增殖。D,C图的统计结果。E,Afp、Dlk1的染色确证给与Fah-/-小鼠YC处理,可以促进移植肝细胞在体内去分化为肝祖细胞。
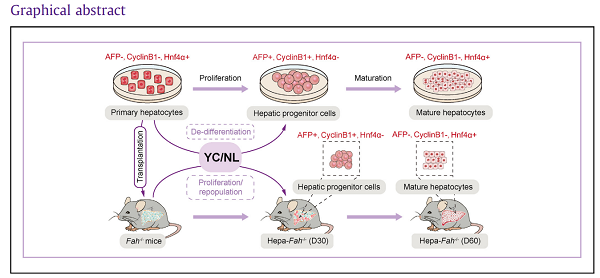
综上,该研究发现了移植后肝细胞在体内增殖的新机制,并建立了利用小分子药物促进移植后肝细胞在体内增殖的新方法(图3)。此研究对解析移植后肝细胞在体内的增殖机制具有重要意义,为肝细胞移植的临床应用打下基础。
图3.化合物组合YC/NL可以诱导肝细胞在体外/体内去分化为肝祖细胞,并可以促进移植的肝细胞在体内的增殖。
上海药物所和上海科技大学联合培养研究生蒋萌萌博士、上海药物所郭任副研究员为文章并列第一作者。上海药物所谢欣研究员为文章通讯作者。该研究获得了中科院器官重建与制造先导专项、国家重点研发计划、国家自然科学基金及中国博士后基金等项目的支持。
(供稿部门:谢欣课题组)