
-

生物通官微
陪你抓住生命科技
跳动的脉搏
蛋白质科学研究团队与油菜团队合作解析植物特有磷脂水解酶工作…
【字体: 大 中 小 】 时间:2023年01月17日 来源:华中农业大学植物科学技术学院
编辑推荐:
南湖新闻网讯(通讯员 范如旖 )近日,湖北洪山实验室、作物遗传改良全国重点实验室蛋白质科学研究团队联合油菜团队在Nature Communications杂志在线发表了题为“Insights into themechanism of phospholipid hydrolysis by plant non-specific phospholipase C”的研究论文

南湖新闻网讯(通讯员 范如旖)近日,湖北洪山实验室、作物遗传改良全国重点实验室蛋白质科学研究团队联合油菜团队在Nature Communications杂志在线发表了题为“Insights into themechanism of phospholipid hydrolysis by plant non-specific phospholipase C”的研究论文。该研究解析了植物特有的磷脂水解酶NPC4的工作机制,为真核生物磷脂水解酶家族的分子机制提供了新见解。
非特异性磷脂酶C(NPC)是植物特有的一类磷脂酶,受低磷胁迫诱导表达。NPCs通过水解细胞质膜上的多种膜磷脂和鞘磷脂,介导膜脂重塑,回收、利用无机磷,维持细胞磷酸盐稳态,在植物的生长、发育过程中发挥重要作用。相比于其它磷脂酶(A1/A2/D/PI-PLC)水解底物的分子机制研究,NPCs是迄今为止唯一一类尚未被阐明的磷脂酶。
刘主课题组联合郭亮课题组,采用多种生物物理技术手段,综合结构分析与动态表征,揭示了植物NPC4水解底物的分子机制(图1)。研究发现,NPC4的三维结构不同于所有已知的磷脂酶,采用独特的结构形式发挥功能;催化口袋位于NPC4的磷脂酶结构域(PD),新鉴定到的C端结构域(CTD)虽然不直接参与底物的水解,但它对于NPC4的活性是必须的,并通过与PD的相互作用,稳定PD的催化口袋,使其形成催化构象。结合生化分析,研究鉴定了NPC4水解底物的关键氨基酸,提出了酶催化反应机理;通过分子对接与分子动力学模拟,团队进一步发现了多种磷脂分子可以结合到NPC4的催化口袋,进而从分子层面证实了NPC4具备低的底物特异性特点。该研究从机制上阐明了植物NPC的工作机理,为磷脂酶家族的催化机理提供了新的机制和见解,可为植物和作物磷高效利用的遗传改良提供重要参考。
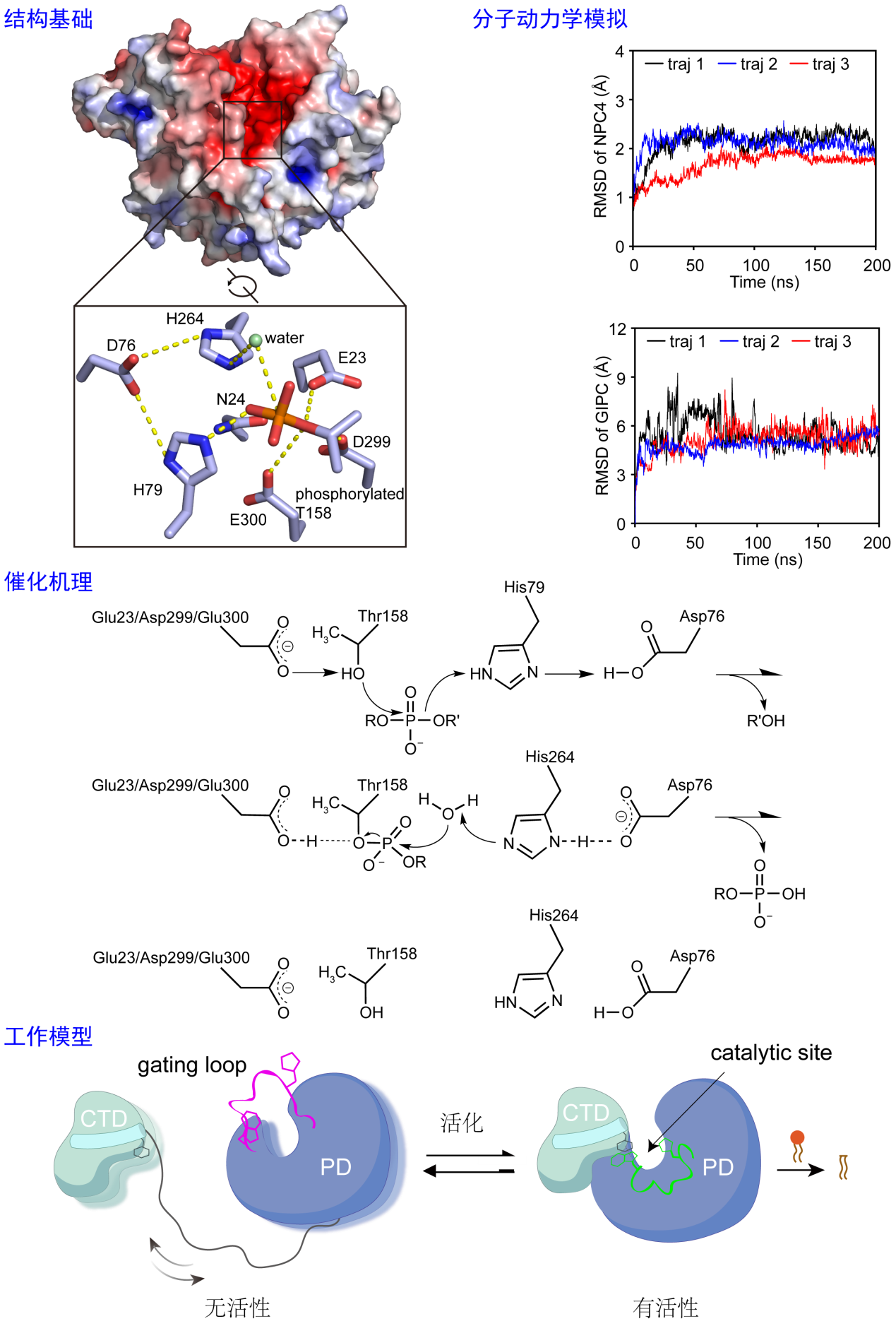
图1. 多技术联用,结合结构基础、动态表征、生化分析,阐明NPC4的CTD稳定PD的催化构象,进而催化底物水解的分子机制。
博士生研究生范如旖、已出站博士后赵芬、中国科学院精密测量科学与技术创新研究院龚洲副研究员为该论文共同第一作者,郭亮教授和刘主教授为共同通讯作者。华中农业大学殷平教授、美国密苏里大学圣路易斯分校/唐纳德丹佛斯植物科学中心王学敏教授、中国科学院精密测量科学与技术创新研究院陈艳可助理研究员参与该研究。校级蛋白质平台为该研究提供了强有力的支持,样品的衍射和散射数据在上海同步辐射光源收集。该研究受到了国家重点研发计划、国家自然科学基金、湖北洪山实验室基金的资助。
【英文摘要】
Non-specific phospholipase C (NPC) hydrolyzes major membrane phospholipids to release diacylglycerol (DAG), a potent lipid-derived messenger regulating cell functions. Despite extensive studies on NPCs reveal their fundamental roles in plant growth and development, the mechanistic understanding of phospholipid-hydrolyzing by NPCs, remains largely unknown. Here we report the crystal structure of Arabidopsis NPC4 at a resolution of 2.1 Å. NPC4 is divided into a phosphoesterase domain (PD) and a C-terminal domain (CTD), and is structurally distinct from other characterized phospholipases. The previously uncharacterized CTD is indispensable for the full activity of NPC4. Mechanistically, CTD contributes NPC4 activity mainly via CTDα1-PD interaction, which ultimately stabilizes the catalytic pocket in PD. Together with a series of structure-guided biochemical studies, our work elucidates the structural basis and provides molecular mechanism of phospholipid hydrolysis by NPC4, and adds new insights into the members of phospholipase family.
论文链接:https://www.nature.com/articles/s41467-023-35915-4
审核:刘主 郭亮
 生物通微信公众号
生物通微信公众号
知名企业招聘