
-

生物通官微
陪你抓住生命科技
跳动的脉搏
DNA“模块化”可编程策略构筑双价配体实现对受体激活的精细调控
【字体: 大 中 小 】 时间:2023年01月13日 来源:上海交通大学医学院
编辑推荐:
近日,上海交通大学医学院肖泽宇课题组与张健课题组合作,在Cell重要子刊Chem在线发表了题为DNA-modularized construction of bivalent ligands precisely regulates receptor binding and activation的研究论文,开发了DNA模块化可编程的策略来构筑双价配体分子,实现在单脱氧核苷酸水平对受体识别及激活构象的精细调控
当前,药物设计及研发的一个热门方向是构筑双价配体分子。该类分子是将两个药效明确的配体分子通过连接子偶联形成;其中,每个配体分子分别识别两个不同蛋白受体的位点、或同一蛋白受体的不同位点(如正构或变构位点),并通过连接子协调配体-受体的相互作用,从而增强药物疗效、提高药物选择性、并克服耐药等[1]。双价配体分子可以调控的蛋白受体众多,如G蛋白偶联受体(GPCR)、激酶、离子通道、氧化酶以及二聚化蛋白等。由于在药物研发上的优势,双价配体分子越来越受到国际各大研究机构的关注,对许多传统意义上不可成药的靶点赋予新的成药潜力,且已有双价配体分子进入临床研究[2],展示了广阔的开发前景。
构筑双价配体分子的关键是连接子的筛选及优化,因为它能够通过调节两个配体分子的空间距离及空间构象,影响药理学活性。当前方法主要采用聚合物(如聚乙烯、聚乙二醇等)作为连接子来构筑并筛选双价配体分子,面临以下问题:首先,聚合物连接子在合成中聚合度难以精确控制,导致难以精准调控药效团之间的空间距离;其次,聚合物连接子常由单一重复单元构成,难以实现配体分子与受体结合时空间取向的精细调节;此外,构筑筛选过程中需要将不同长度及结构组成的聚合物连接子逐一与药效团进行化学偶联,合成及纯化步骤繁琐。综上,双价配体分子的高效构筑及精细调控是制约本领域发展的瓶颈问题。
近日,上海交通大学医学院肖泽宇课题组与张健课题组合作,在Cell重要子刊Chem在线发表了题为DNA-modularized construction of bivalent ligands precisely regulates receptor binding and activation的研究论文,开发了DNA模块化可编程的策略来构筑双价配体分子,实现在单脱氧核苷酸水平对受体识别及激活构象的精细调控。该策略借鉴DNA分子的可编程构筑方式,将两个配体分子分别修饰成可用于DNA固相合成的“类核苷酸”药效团模块,将天然脱氧核苷酸作为连接子模块,并利用DNA固相合成仪,自动化高效构筑双价配体分子的筛选库。通过编程脱氧核苷酸的数目来精细调节连接子的长度,实现对两个药效团之间空间距离在0.33纳米尺度的调控;通过编程脱氧核苷酸的碱基排列来调节连接子的结构多样化,实现对药效团空间取向的精细调控,从而高效筛选获得对受体识别亲和力最高、激动效能最强的双价配体分子。该策略为双价配体分子的设计开发提供了全新的思路,在药物设计及生物医学研究领域具有广泛的应用前景。

为证实此设计策略的可行性,团队结合各自的研究优势,针对同一蛋白受体的正构和变构位点,构筑了一个“正构-变构”双价配体分子,即一个配体分子与蛋白受体的正构位点结合,另一个配体分子与变构位点结合。具体而言,本工作中蛋白受体选用M1毒蕈碱型乙酰胆碱受体(M1Rs),是一类与认知功能、肿瘤发生发展密切相关的GPCR受体。双价配体分子中,一个配体分子为正构激动剂占诺美林(简称X),识别M1Rs的正构位点;另一个配体分子为变构调节剂BQCA(简称B),识别M1Rs的变构位点。通过这样一个“正构-变构”双价配体分子的协同调节,实现对M1受体(而非M2~M5受体)亚型的识别及激动选择性,降低副作用。
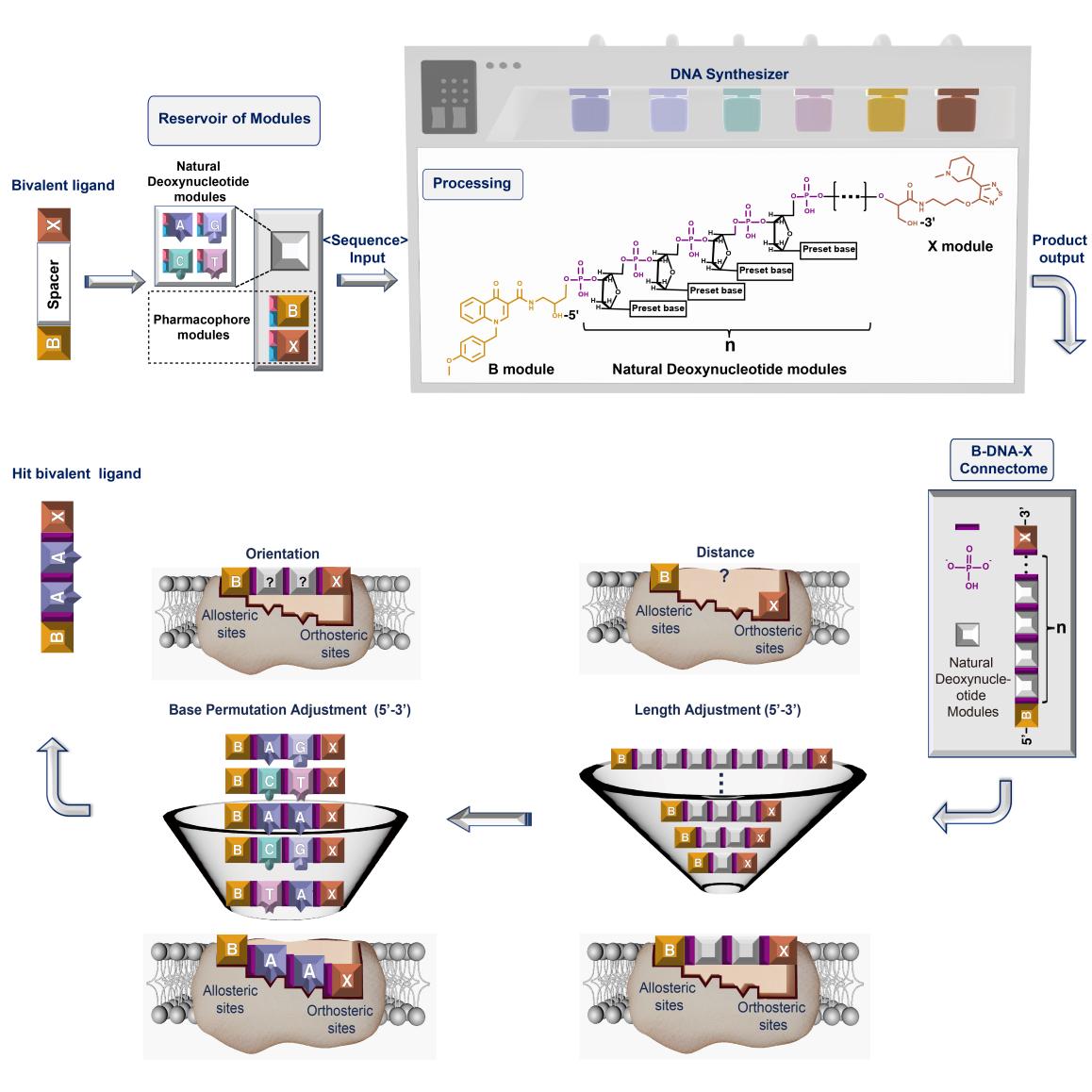
研究团队首先借鉴天然脱氧核苷酸的修饰策略构建了X与B的药效团模块,并证实修饰后保留了原药的活性。进一步,利用DNA固相合成技术,设计了药效团间含有1-7个脱氧核苷酸的双价配体,筛选发现当连接子为两个脱氧核苷酸时,双价配体对于M1受体的选择性最强。在此基础上,对两个脱氧核苷酸的碱基排列进行编程,得到16种含有不同结构组成连接子的双价配体库,筛选发现单脱氧核苷酸水平排列的差异化使双价配体对M1受体激动的效价强度呈现出最低10-3的细微改变,且当连接子的碱基排列为“AA”时,双价配体选择性激动M1受体的能力最强,比传统方法提高近30倍。
最后,研究团队探讨了此最优双价配体与M1受体作用的分子机制。通过分子对接预测并实验证实了此双价配体与M1受体作用的氨基酸位点。据此通过分子动力学模拟,发现BAAX双价配体可将M1受体构象稳定在其激活构象最接近的状态,从而展示了强效激活M1受体的能力。
上海交通大学医学院肖泽宇教授与张健教授为该论文的通讯作者。上海交通大学医学院赵娜博士、吴文伟博士、王颖硕士为该论文的第一作者。该工作受到上海交通大学医学院分子医学研究院谭蔚泓院士和教育部共建上海市生物医药临床研究与转化协同创新中心陈红专教授等的指导和大力支持。
专家点评:
樊春海(中国科学院院士, DNA科学技术领域专家)
DNA作为万物生命起源的主要遗传分子,无论是从生物学性质、化学结构、合成方式等,均为人类文明进步发展带来了许多启迪。例如,科学家受到天然DNA分子碱基互补配对原则的启发,开发了DNA分子逻辑门计算机,实现了在生物体内进行数字运算[3];利用DNA内部相邻核苷酸间距为3.3Å的特点,实现对于发色团,荧光基团以及蛋白质等距离的精确控制[4];受到天然DNA的连接化学启示而开发出的DNA固相合成技术,实现了对于DNA这种大分子聚合物聚合度的精确控制[5]。近年来,利用DNA的精确性和可编程性特点,人们开始拓展DNA工程在生物医学方面的应用,如设计DNA纳米机器人用于可编程的药物输送[6];制造基于DNA的分子疫苗,通过控制抗原间距和尺寸以达到最大的B细胞反应[7];及利用DNA折纸对距离的精确控制实现脂质转移[8]。然而,到目前为止,尚未揭示DNA是否可以作为双价配体分子之间的连接子来精细调节配体-受体的识别构象。
肖泽宇教授和张健教授团队等近期合作发表的Chem率先阐明了DNA为药物或探针分子设计带来的新启示。在该项工作中,研究团队另辟蹊径的关注到了DNA作为双价配体分子中连接子的潜力,并用于开发“正构-变构“共同作用的双价配体分子库中。双价配体包含两个药效团,并需要通过连接子偶联构成一个分子。不同长度及化学组成的连接子会对整个双价配体分子的性质产生影响。传统方法利用聚合物做连接子难以实现精细调节,且主要依赖分步液相合成方法实现双价配体的构筑,然而不同长短和结构组成的连接子偶联涉及较为繁琐的过程。该项工作开发了双价配体的“DNA模块化”构筑策略,利用DNA的结构单元脱氧核苷酸作为连接子,巧妙地解决了这一问题。通过将正构和变构药效团分别修饰成为用于固相合成的原料模块,即可借助DNA自动合成技术,构建一系列具有精确差异的药效团空间距离和空间取向的双价配体分子;此外,DNA模块化策略极大简化了双价配体分子合成的步骤,便于高效构筑双价配体候选分子库。
更独特的是,该策略实现了双价配体对受体识别在单脱氧核苷酸水平的调控。增减脱氧核苷酸数目,即可在埃到纳米尺度调控两个药效团之间的空间距离;更换脱氧核苷酸的碱基类型即可精细调节药效团的空间取向,从而真正实现了对药效团间距及空间取向的精细调控。
此研究充分体现了化学、生物、药学、工程的学科交叉,是DNA在药物或探针分子设计领域、尤其是双识别位点分子设计领域的开拓性工作,揭示了DNA作为药效团之间连接子,精细调控药物与靶点(或配体与受体)识别构象的全新可能及独特优势,为研发新型双价配体探针或双价药物分子提供了全新视角及构筑策略。该方法与传统方法相比,无论是在结构功能调控的精准性,还是在双价分子合成的简便性都有巨大的提升,充分展示出DNA结构精确可控的特点及作为连接子的强大优势。总而言之,该研究无论在药物或探针分子设计领域,还是在DNA纳米技术的生物医药应用领域,都是极具启发的开创性工作,有望为双价配体探针或双价药物分子的研发提供通用型设计平台,并拓展了DNA作为功能元件在生物医药领域的应用。