
-

生物通官微
陪你抓住生命科技
跳动的脉搏
我室陈明周教授课题组在宿主蛋白调节HPIV3复制的机制研究方面取得新进展
【字体: 大 中 小 】 时间:2022年09月21日 来源:武汉大学病毒学国家重点实验室
编辑推荐:
近日,国际学术期刊 PLOS Pathogens 杂志在线发表了病毒学国家重点实验室陈明周教授课题组的最新研究成果,论文题目为 “Vimentin inhibits α-tubulin acetylation via enhancing α-TAT1 degradation to suppress the replication of human parainfluenza virus type 3”
近日,国际学术期刊PLOS Pathogens杂志在线发表了病毒学国家重点实验室陈明周教授课题组的最新研究成果,论文题目为“Vimentin inhibits α-tubulin acetylation via enhancing α-TAT1 degradation to suppress the replication of human parainfluenza virus type 3”。

人副流感病毒三型(Human parainfluenza virus type 3,HPIV3)是副粘病毒科(Parainfluenza)典型致病病毒,是最常见的婴幼儿呼吸道病毒之一。HPIV3感染可导致婴幼儿上呼吸道和下呼吸道感染,严重的可致死亡,给家庭和社会带来很大损失,但至今无无疫苗及药物上市。因此,揭示HPIV3病毒的复制机制,并寻找相关抗病毒宿主蛋白的研究具有重大意义。
HPIV3所形成的包涵体是病毒RNA合成的重要场所,而N-P复合物是组成包涵体的重要复合物。陈明周教授课题组通过利用免疫共沉淀技术,筛选到大量与N-P复合物相互作用的宿主蛋白,并从中鉴别到宿主蛋白VIM,发现该
蛋白可以抑制病毒复制以及病毒包涵体的形成。
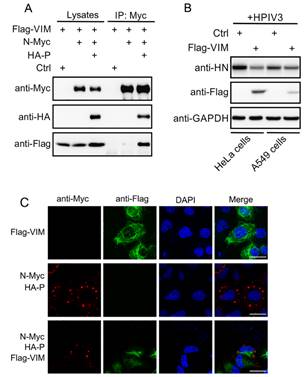
图一、VIM蛋白抑制HPIV3的复制与包涵体形成
A、免疫共沉淀揭示VIM蛋白与N-P复合物具有相互作用
B、蛋白水平显示VIM蛋白抑制HPIV3的复制
C、免疫荧光显示VIM蛋白抑制HPIV3包涵体的形成
随后的研究揭示,VIM蛋白可以通过其N端的Head区域结合N-P复合物和微管乙酰转移酶α-TAT1,并且抑制N-P复合物与α-TAT1的互作,促进α-TAT1降解,这导致微管乙酰化水平降低,从而抑制病毒复制结构形成和病毒RNA合成效果。更进一步地,确定了VIM的N端61-80位的氨基酸残基,是介导VIM与N-P复合物互作的关键区域,而来自该区域的多肽,对HPIV3的复制具有明显抑制效果。
总之,该研究发现VIM蛋白通过促进微管乙酰转移酶α-TAT1的降解,导致微管乙酰化水平降低,从而抑制HPIV3复制的抗病毒机制。这项研究首次揭示了VIM蛋白抑制HPIV3复制的分子机制,并鉴定到一段来源于VIM蛋白的抗病毒多肽,为抗HPIV3药物研发提供了新的思路
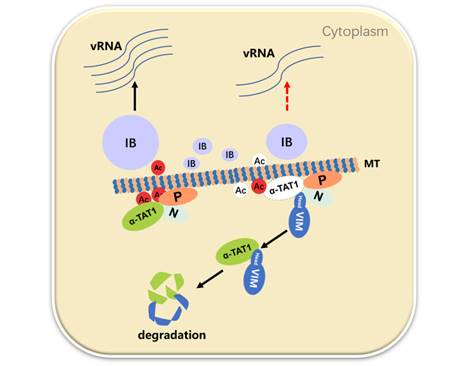
图二、VIM蛋白抑制HPIV3复制的模式图
武汉大学生命科学学院/病毒学国家重点实验室、武汉大学泰康生命医学中心陈明周教授, 武汉大学生命科学学院/病毒学国家重点实验室覃雅丽副教授为该论文共同通讯作者,博士生刘朋飞和湖北中医药大学张胜威副教授为共同第一作者。该研究得到了国家自然科学基金、国家重点研发计划等的资助。
论文链接:https://doi.org/10.1371/journal.ppat.1010856