
-

生物通官微
陪你抓住生命科技
跳动的脉搏
袁晶课题组在eLife发表研究论文,揭示疟原虫细胞形态控制的分子机制
【字体: 大 中 小 】 时间:2022年07月22日 来源:厦门大学生命科学学院
编辑推荐:
7月18日,袁晶课题组在eLife杂志上发表题为 Inner membrane complex proteomics reveals a palmitoylation regulation critical for intraerythrocytic development of malaria parasite的研究论文
7月18日,袁晶课题组在eLife杂志上发表题为 Inner membrane complex proteomics reveals a palmitoylation regulation critical for intraerythrocytic development of malaria parasite的研究论文。该研究揭示了疟原虫细胞形态控制的分子机制。

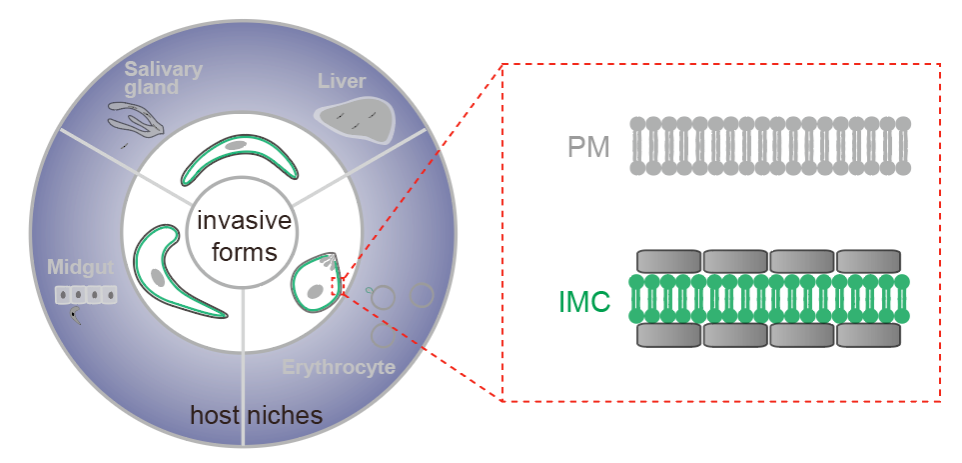
原生动物-疟原虫是疟疾传染病的致病病原,每年导致数亿人口感染和数十万人死亡。具有感染能力的疟原虫呈现细胞极性,极性细胞形态对疟原虫感染宿主至关重要。以疟原虫为代表的顶复门寄生原虫的细胞质膜(plasma membrane,PM)下方具有独特的膜细胞器---内膜复合物(inner membrane complex,IMC),对于极性细胞形态的建立和维持起到关键作用。课题组之前工作中揭示了IMC调控表皮微管骨架(The EMBO Journal,2020)和细胞运动(Current Biology,2018)的生理功能和分子机制。然而,IMC细胞器的蛋白组分及其定位机制依然未知。
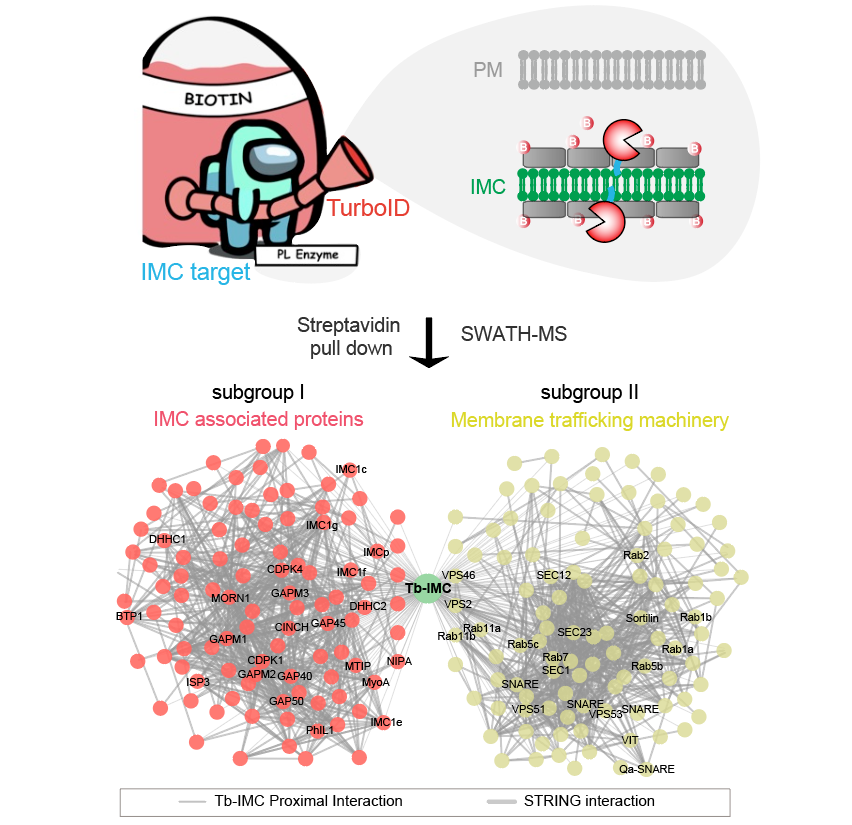
该工作结合蛋白临近标记和蛋白质质谱方法,揭示了疟原虫IMC细胞器的蛋白质组分。结合生物信息学分析,发现一类IMC相关的胞内囊泡转运蛋白。该工作为进一步阐明IMC产生和维持的分子机制提供了重要的基础数据。
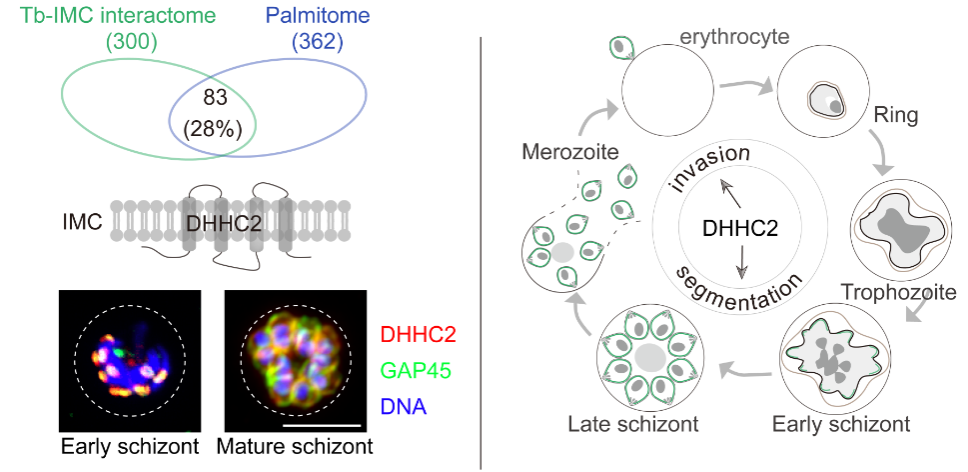
该工作还发现IMC蛋白存在广泛的棕榈酰化修饰,提示IMC蛋白通过棕榈酰化修饰实现细胞器特异定位。进一步工作发现,棕榈酰转移酶DHHC2在IMC特异表达定位。DHHC2通过棕榈酰化修饰,控制包括CDPK1和GAP45等特定IMC蛋白的细胞定位和功能,从而调控疟原虫的细胞形态和红细胞入侵。
厦门大学生命科学学院博士生钱鹏戈、博士后王旭和钟传奇副教授为本文第一作者;袁晶教授为本文通讯作者,厦门大学为第一完成单位。该研究得到国家自然科学基金和厦门大学校长基金资助。
论文全文链接:https://elifesciences.org/articles/77447#content
(图/文 袁晶课题组)