
-

生物通官微
陪你抓住生命科技
跳动的脉搏
河南省脑靶向生物纳米药物重点实验室在ACS Nano和Journal of Controlled Release发表最新GBM治疗研究进展
【字体: 大 中 小 】 时间:2022年04月03日 来源:河南大学生命科学学院
编辑推荐:
近日,河南省脑靶向生物纳米药物重点实验室先后在国际知名期刊ACS Nano (IF=15.88 ,一区Top )和Journal of Controlled Release (IF=9.76 ,一区Top )发表2 篇脑胶质瘤治疗研究论文
近日,河南省脑靶向生物纳米药物重点实验室先后在国际知名期刊ACS Nano(IF=15.88,一区Top)和Journal of Controlled Release(IF=9.76,一区Top)发表2篇脑胶质瘤治疗研究论文。
脑靶向仿生纳米载体共递送Bcl-2/Bcl-xl和Mcl-1抑制剂用于原位胶质母细胞瘤治疗
胶质母细胞瘤(GBM)是最常见的恶性脑胶质瘤,治疗难度大、易复发。当前临床上胶质瘤治疗面临的最棘手的问题之一是胶质瘤细胞易对放疗、化疗产生耐受/药性。由抗凋亡蛋白Bcl-2/Bcl-xl及Mcl-1过表达导致的癌细胞内部凋亡通路异常是造成胶质瘤耐受/药性问题的重要原因。近年来,能够选择性的靶向并且阻断癌细胞内特定信号通路的小分子抑制剂在癌症治疗领域吸引了研究者们越来越多的关注。与传统化疗药物相比,小分子抑制剂不仅选择性更高、副作用更小,而且可以在一定程度上克服肿瘤耐药性(靶向肿瘤耐药基因)。ABT-263(ABT)是一种有效的口服类抗凋亡蛋白抑制剂,它可以选择性的与细胞内的Bcl-2/Bcl-xl蛋白结合并抑制其抗凋亡活性,进而促进线粒体介导的细胞凋亡,对多种抗凋亡蛋白高表达的肿瘤细胞具有强的杀伤作用。然而,在临床试验中,ABT的抗肿瘤活性并不令人满意,并且会造成血小板降低等不良反应的产生。此外,ABT对Mcl-1的结合亲和力和抑制能力均较差,在Mcl-1蛋白高表达的肿瘤细胞中,Mcl-1通常会对ABT药效的发挥产生拮抗作用(研究证实接受ABT治疗会使得癌细胞内的Mcl-1进一步上调),严重阻碍了ABT在GBM治疗中的前景。实验室发现Mcl-1特异性抑制剂A-1210477(A12)能够通过抑制Mcl-1的功能增强ABT对脑胶质瘤细胞的毒性。研究结果证实,ABT与A12联合使用能够诱导包括U87 MG、耐药U251脑胶质瘤细胞和患者来源的脑胶质瘤干细胞在内的多种癌细胞发生线粒体途径的细胞凋亡。鉴于小分子抑制剂血液半衰期短且难以跨过血脑屏障的不足,课题组进一步设计了一种基于载脂蛋白E(ApoE)多肽修饰的红细胞膜为外壳的酸敏感仿生纳米载体,靶向递送ABT和A12至肿瘤部位,从而达到治疗原位脑胶质瘤的目的。
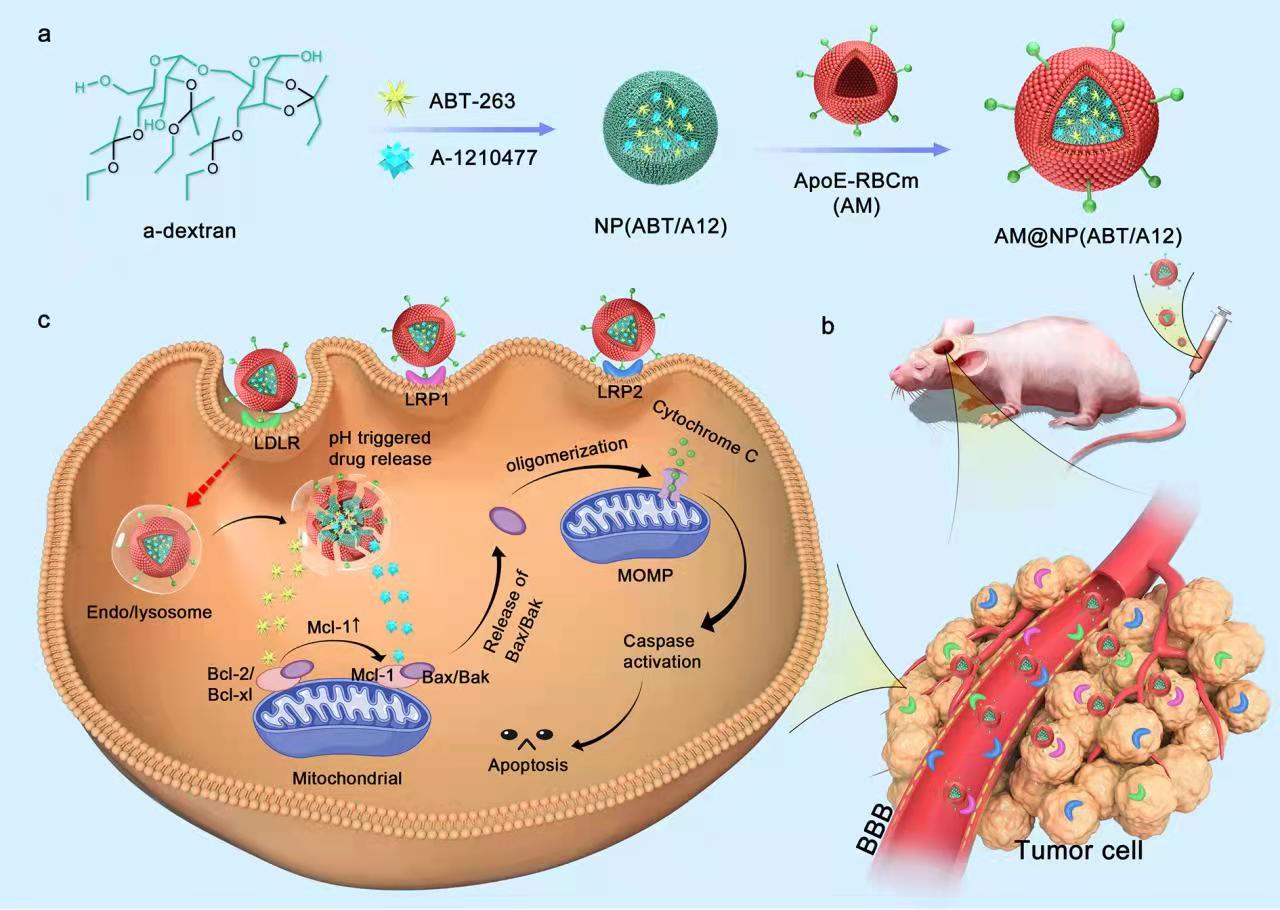
值得一提的是,当制备成纳米药物之后,两种抑制剂仍能实现协同抗肿瘤疗效。动物活体实验结果表明,所得纳米药物具有长的血液循环时间,能够有效穿越血脑屏障、靶向脑胶质瘤。荷瘤小鼠接受该仿生纳米药物治疗之后,肿瘤的生长得到了明显的抑制,生存周期得到了有效的延长。此外,将小分子抑制剂负载到仿生纳米载体的策略也降低了抑制剂对生物体的毒副作用(血小板毒性)。
该成果以“Brain-Targeted Codelivery of Bcl-2/Bcl-xl and Mcl-1 Inhibitors by Biomimetic Nanoparticles for Orthotopic Glioblastoma Therapy”发表在ACS Nano期刊上。
河南大学博士后研究员何文亚为该论文第一作者,冰洋教授、邹艳副教授为共同通讯作者。该研究得到了博士后科学基金、国家自然科学基金、科技部基金等资助。
论文链接:https://pubs.acs.org/doi/abs/10.1021/acsnano.2c00320
靶向外泌体的血红素加氧酶-1对替莫唑胺耐药胶质母细胞瘤的协同治疗
胶质母细胞瘤(GBM)是一种高致死率和复发性的脑癌,目前尚无完全有效的治疗方法。尽管基于合成纳米技术的方法显示出极好的治疗潜力,但相关的生物安全性是从实验室到临床转化的主要障碍。因此,实验室探索用血红素加氧酶-1 (HMOX1)特异性短肽(HSSP)修饰骨髓间充质干细胞外泌体(BMSCExo)作为替莫唑胺(TMZ)和小干扰RNA (siRNA)纳米载体治疗耐药胶质母细胞瘤。BMSCExo具有良好的TMZ和siRNA负载能力,并可利用其固有的脑聚集特性穿越血脑屏障(BBB)。值得注意的是,由于HMOX1在耐药GBM细胞中过表达,HSSP修饰的BMSCExo在体外和体内均表现出良好的耐药GBM靶向能力。此外, BMSCExo将STAT3靶向siRNA传递到TMZ耐药胶质瘤后,恢复了TMZ敏感性,从而实现TMZ与siRNA的协同治疗。
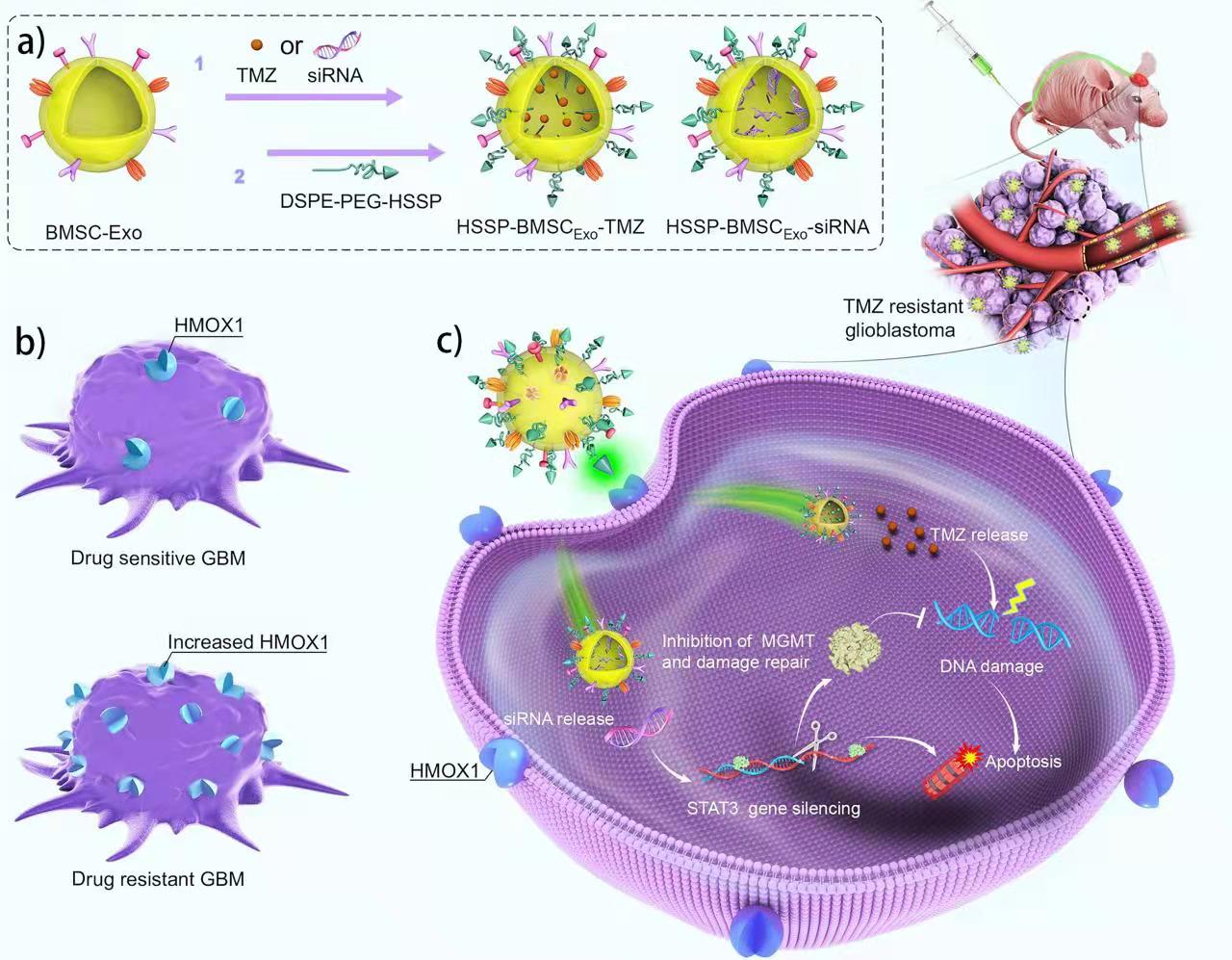
这种HMOX1靶向的基于BMSC的外泌体平台有潜力用于脑胶质瘤治疗的临床转化,并且还可应用于治疗其他HMOX1过表达的脑部疾病。该成果以“Heme Oxygenase-1 targeting exosomes for temozolomide resistant glioblastoma synergistic therapy”为题发表在Journal of Controlled Release期刊上。
河南大学博士后研究员Fawad Ur Rehman、刘洋和硕士生杨青山为该论文共同第一作者,冰洋教授、郑蒙教授为共同通讯作者。该研究得到了国家自然科学基金、科技部基金等资助。
论文链接:https://doi.org/10.1016/j.jconrel.2022.03.036
河南省脑靶向生物纳米药物重点实验室网址:https://bs.henu.edu.cn/