
-

生物通官微
陪你抓住生命科技
跳动的脉搏
【科研动态】华中科技大学生命学院李子福教授与同济医院孙朝阳教授在肿瘤靶向纳米药物方向取得新进展
【字体: 大 中 小 】 时间:2022年12月30日 来源:华中科技大学生命与科学技术学院
编辑推荐:
2022年12月16日,华中科技大学生命学院、国家纳米药物工程技术研究中心李子福教授与同济医院孙朝阳教授在国际权威期刊Acta Biomaterialia上合作发表题为“ Codelivery of adavosertib and olaparib by tumor-targeting nanoparticles for augmented efficacy and reduced toxicity ”的研究论文
2022年12月16日,华中科技大学生命学院、国家纳米药物工程技术研究中心李子福教授与同济医院孙朝阳教授在国际权威期刊Acta Biomaterialia上合作发表题为“Codelivery of adavosertib and olaparib by tumor-targeting nanoparticles for augmented efficacy and reduced toxicity”的研究论文。
卵巢癌是妇科肿瘤死亡率最高的恶性肿瘤,发病隐匿,约有75%的患者诊断即为晚期,5年生存率仅为30%-40%。聚(ADP-核糖)聚合酶(PARP)抑制剂的出现为卵巢癌的治疗提供了新的选择。其中Olaparib已被美国食品和药物管理局批准用于治疗卵巢癌患者,但其使用限制于发生BRCA突变的患者。我们在前期的基础研究中发现Olaparib和WEE1抑制剂(如:adavosertib)联合应用可以通过改变细胞周期的进展,促进细胞死亡,并且这种作用不受BRCA状态的影响。然而,这两种药物的联合应用毒副作用明显,机体往往无法耐受。
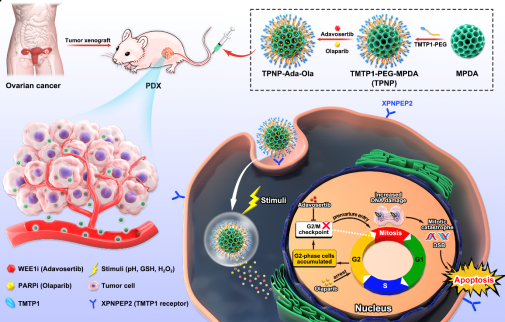
图1:TPNP-Ada-Ola纳米载药系统的构建及其作用机制。
针对以上问题,借助于纳米载药系统的优势,在这项工作中,我们设计了一种肿瘤靶向肽TMTP1修饰的基于介孔聚多巴胺(MPDA)的纳米给药系统(TPNPs),用于靶向联合递送Adavosertib和Olaparib来治疗卵巢癌。Adavosertib和Olaparib可以有效地加载到MPDA纳米平台中,并显示出肿瘤微环境触发的释放行为。结果显示这种肿瘤靶向的纳米药物递送系统能够在增强Adavosertib和Olaparib协同治疗的同时显著降低联合给药造成的毒副作用。这项工作为靶向递送WEE1抑制剂和PARP抑制剂治疗卵巢癌提供了一种新的思路。
同济医院博士生王伟与生命学院博士生熊雨轩为该论文的共同第一作者,同济医院孙朝阳教授和生命学院李子福教授为文章的共同通讯作者。
文章链接:https://doi.org/10.1016/j.actbio.2022.12.021