
-

生物通官微
陪你抓住生命科技
跳动的脉搏
上海交大药学院研究团队发表STING信号通路介导新冠多重机制的研究进展综述
【字体: 大 中 小 】 时间:2022年12月16日 来源:上海交大 新闻学术网
编辑推荐:
2019年底以来,由新型冠状病毒(SARS-CoV-2)感染导致的新型冠状病毒肺炎(COVID-19)在全球迅速蔓延,累计确诊病例超6亿,死亡病例超600万,严重威胁人类健康和公共卫生安全。目前已有多款药物被批准用于新冠治疗,包括用于轻症的辉瑞口服药Paxlovid,默沙东口服药Molnupiravir,用于轻症及重症的Remdesivir,用于重症...
2019年底以来,由新型冠状病毒(SARS-CoV-2)感染导致的新型冠状病毒肺炎(COVID-19)在全球迅速蔓延,累计确诊病例超6亿,死亡病例超600万,严重威胁人类健康和公共卫生安全。
目前已有多款药物被批准用于新冠治疗,包括用于轻症的辉瑞口服药Paxlovid,默沙东口服药Molnupiravir,用于轻症及重症的Remdesivir,用于重症及危重症的糖皮质激素,IL-6受体阻滞剂和Baricitinib,以及我国真实生物公司研制的用于治疗COVID-19成年患者的阿兹夫定等。快速研发的多种疫苗也为新冠防治作出了巨大的贡献。然而现有的药物和疫苗不足以对抗持续出现的病毒变异株,因此迫切需要开发新的预防和治疗措施,以防治新冠的持续突变和传播。
天然免疫系统作为人体的第一道防线,通过模式识别受体感知病毒,激活炎症反应促进病毒清除。其中,干扰素基因刺激因子(Stimulator of interferon genes,STING)信号通路是天然免疫系统的重要成员,通过感受来自病原体的DNA,激活下游干扰素响应,发挥抗病毒作用。SARS-CoV-2作为一种典型的RNA病毒,主要由宿主细胞内的RNA感受器RLR识别,而不是由DNA感受器STING识别。然而,越来越多的证据表明,STING信号通路对SARS-CoV-2的感染同样具有抑制效果,而SARS-CoV-2编码蛋白质也可以拮抗STING信号通路。STING信号通路与SARS-CoV-2的感染和复制间具有复杂的关系。
2022年12月8日,上海交通大学药学院张翱教授课题组在Frontiers in immunology上发表了题为“Involvement of the STING signaling in COVID-19”的综述文章,对目前已报道的SARS-CoV-2和STING信号通路间的联系进行了总结,讨论了病毒蛋白对STING通路的拮抗机制以及宿主细胞对STING通路的激活作用,强调了SARS-CoV-2感染过程中STING持续激活导致的炎症异常,总结了STING激动剂对SARS-CoV-2的抗病毒作用,以及STING激动剂作为疫苗佐剂在新冠疫苗研发中的潜在应用价值。

SARS-CoV-2病毒与STING信号通路间的关系紧密而复杂,在新冠感染初期,病毒通过自身蛋白与STING的直接结合抑制STING通路的激活,减弱宿主的天然免疫响应,为病毒的复制提供时间。随着感染进程的发展,宿主体内病毒数量逐渐增加,病毒与宿主细胞融合形成合胞体,其中的微核由于基因组不稳定,激活STING通路介导炎症响应,在对病毒进行一定杀伤的同时,过度的免疫反应也会导致严重的肺部炎症和并发症。因此,STING激动剂或抑制剂有希望应用于SARS-CoV-2病毒的防治,例如在感染早期使用STING激动剂以激活机体内的天然免疫响应杀伤病毒抑制其复制,在感染中晚期使用STING抑制剂减弱机体的过度免疫响应,减少肺部炎症(图1)。但STING调节剂在新冠防治中的具体应用仍需进一步研究,包括具体的用药时机以及用药标准等,该文章提出或可根据患者体内干扰素响应水平判断应采用STING激动剂或抑制剂。目前,张翱团队正在进行相应的靶向STING通路的激动剂(J. Med. Chem. 2021, 64,1649-1669.)和拮抗剂研究(J. Med. Chem. 2021, 64, 7667-7690.)。
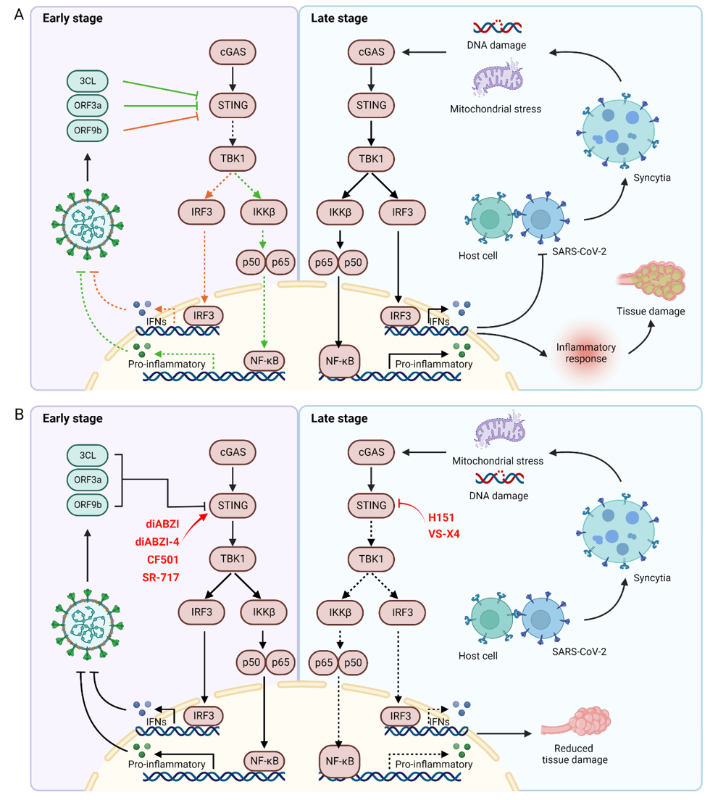
图1 SARS-CoV-2与STING信号通路间的相互作用
(图源: Xiao RX. et al., Front Immunol, 2022)
论文链接:https://www.frontiersin.org/articles/10.3389/fimmu.2022.1006395/full
上海交通大学药学院博士后肖若璇为该文章的第一作者,张翱教授为通讯作者。