
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Neuron | 陈雷研究组报道胞内钙离子对TRPC3/6通道调..
【字体: 大 中 小 】 时间:2022年01月27日 来源:北京大学前沿交叉学科研究院
编辑推荐:
经典型瞬时受体电势通道TRPC是一类通透钙离子的非选择性阳离子通道1,与最早在果蝇感光系统中发现的TRP通道的序列相似性最高2,3,并且可以被第二信使DAG所激活。根据序列相似性以及通道的电生理特性,TRPC3/6/7形成了一个亚类4。TRPC3/6.....

经典型瞬时受体电势通道TRPC是一类通透钙离子的非选择性阳离子通道1,与最早在果蝇感光系统中发现的TRP通道的序列相似性最高2,3,并且可以被第二信使DAG所激活。根据序列相似性以及通道的电生理特性,TRPC3/6/7形成了一个亚类4。TRPC3/6/7通道参与多种神经活动,例如TRPC3在中枢神经系统高表达,参与神经生长因子BDNF信号转导5,同时TRPC3还与神经突触信号传递以及运动协调有关6,7。TRPC6通道可以促进神经元存活以及兴奋性突触的形成等8,9。除此之外,TRPC3/6/7通道也参与肌源性血管收缩,血压调节等过程,并且和多种疾病的发生有关,比如病理性心肌肥大,癌症发生,糖尿病等10。其中人源TRPC6基因功能获得性突变(GOF)会引发局灶节段性肾小球硬化症(FSGS)11,12。因此,TRPC6通道的抑制剂有望用于治疗该类疾病。2007年有低分辨率冷冻电镜研究表明TRPC3的胞质区可能存在一个空腔13,但由于分辨率所限,以及重构所得电子密度存在较多噪音,该空腔的具体结构细节并不清楚。2017年陈雷课题组和吕伟-杜鹃课题组分别独立报道了TRPC6和TRPC3的高分辨率冷冻电镜结构14,15,这些结构展示了该通道的整体架构,并显示在TRPC3/6通道中的确存在一个“胞质内空腔”。随后,Amgen公司报道了TRPC6通道与抑制剂及激活剂的复合物结构16。尽管如此,该领域仍然存在着重要的科学问题尚待解决。比如,此前研究表明Ca2+可以调控TRPC3/6/7通道的活性17-22,但其调控机制以及FSGS相关突变体的致病机制仍不清楚。
2022年1月19日,生命科学联合中心、北京大学未来技术学院分子医学研究所陈雷研究组在Neuron杂志上报导了Ca2+对人源TRPC3/6调控的结构机制以及FSGS相关突变体的致病机制。
在对TRPC3/6通道研究的过程中,作者们使用内面向外式膜片钳技术发现胞质侧Ca2+可以抑制TRPC3通道本底电流,而对TRPC6通道本底电流展现出低浓度激活高浓度抑制的现象。随后他们发现Ca2+可以提高纯化的TRPC3/6蛋白样品的热稳定性,确定了Ca2+可以与TRPC3/6蛋白直接结合。为了明确Ca2+调控TRPC3/6的结构机制,作者们解析了TRPC3/6通道的一系列高分辨率冷冻电镜结构。通过结构比较,作者们在TRPC3/6中发现了3个Ca2+结合位点(CBS1-3)。随后的点突变、电生理和热稳定性实验证实了CBS1为Ca2+抑制性位点,CBS3为Ca2+激活性位点。Ca2+在抑制性CBS1的结合导致TRPC3/6通道胞内区的结构更加紧凑,使阳离子无法从胞质内空腔中顺利流出,从而使电流减弱。进一步地,作者们使用全细胞记录模式,发现Ca2+通过抑制性CBS1和激活性CBS3对DAG激活的TRPC3/6电流同样产生调节作用。
结构显示在FSGS疾病中发现的TRPC6 GOF点突变都分布于胞内区亚基间相互作用的界面上,有可能破坏了亚基间的相互作用。为了验证此假说,作者们解析了GOF突变体的结构,并通过电生理和热稳定性实验发现GOF突变体减弱了抑制性Ca2+结合位点(CBS1)的作用,使胞内区结构变得松散,从而打开了阳离子从胞质内空腔向胞质区流出的孔道。
最后作者们解析了BTDM以及SAR7334与TRPC6结合的高分辨率结构(2.9 ?),明确了这些抑制剂与TRPC6结合的模式。
综上所述,本项研究通过结构解析以及功能验证,确定TRPC3/6通道在胞质区有一个抑制性Ca2+结合位点CBS1。当Ca2+浓度较高时,该位点会结合Ca2+,促进多个胞质区结构域之间的紧密堆积,从而抑制阳离子从TRPC通道胞质内空腔向细胞质的流动。当Ca2+浓度较低时,Ca2+从该位点解离,使胞质区呈现较为松散的结构,从而打开了离子从胞质内空腔向胞质区流动的通路。这个抑制位点提供了Ca2+对TRPC通道的负反馈调节。TRPC通道在跨膜区还具有激活型Ca2+结合位点CBS3。抑制型和激活型Ca2+结合位点的作用相互叠加,导致了TRPC通道对胞内钙离子浓度复杂的响应。而在FSGS患者中发现的TRPC6 GOF突变破坏了TRPC6胞质区的抑制性CBS1的功能,但不影响激活型CBS3的功能,从而使突变体通道在有Ca2+流入的情况下发生正反馈而持续激活,肾脏足细胞Ca2+离子过载,最终引发FSGS疾病的发生(图1)。此外,不同小分子抑制剂BTDM和SAR7334在TRPC6上的结合位点迥异,并且使TRPC6处于不同的关闭构象,从而为基于结构的药物设计提供了理论支持。
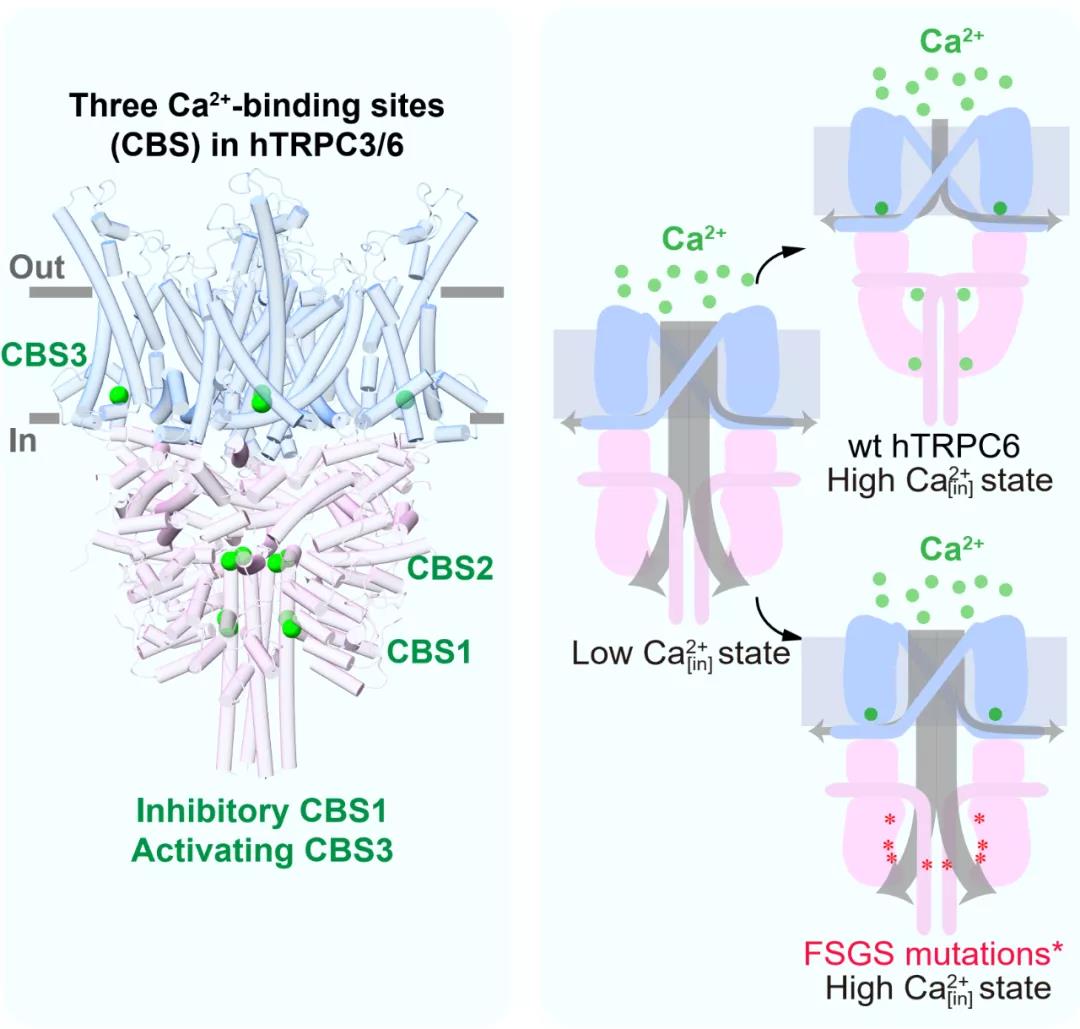
图1 Ca2+通过CBS1-3对TRPC3/6及FSGS相关突变体的调控模式图
本项研究的第一作者为北京大学未来技术学院分子医学研究所博士研究生郭文君;博士生汤晴麟、韦淼,博士后康云路和吴惊香参与了部分实验;陈雷研究员为通讯作者。本项研究中的小分子BTDM由迪哲医药有限公司张小林博士提供;北京大学分子医学研究所周专教授及其博士生李祎曼、北京大学生命科学学院王世强教授、北京师范大学生命科学学院王友军教授以及北京航空航天大学杨亚雄博士在电生理实验和数据分析方面给予了指导和帮助。本工作获得国家自然科学基金委、生命科学联合中心等经费支持。该工作的冷冻电镜样品制备、筛选和采集在北京大学电镜室和冷冻电镜平台上完成,得到了李雪梅、郭振玺、邵博、裴霞和王国鹏等人的帮助。该项目的部分数据处理获得了北京大学CLS计算平台及未名超算平台的硬件和技术支持。
陈雷实验室主要研究膜蛋白特别是与代谢类疾病和心血管疾病相关的重要膜蛋白的工作机制(http://www.imm.pku.edu.cn/kytd/rcdw/34142.htm)。陈雷实验室长期招聘博士后,希望有细胞生物学、生物化学、电生理、抗体制备或结构生物学背景的博士加入该实验室。
参考文献
1. Feng, S. TRPC Channel Structure andProperties. Adv. Exp. Med. Biol. 976, 9-23,doi:10.1007/978-94-024-1088-4_2 (2017).
2. Wes, P. D. et al. TRPC1, a human homolog of aDrosophila store-operated channel. Proc.Natl. Acad. Sci. U. S. A. 92,9652-9656 (1995).
3. Zhu, X., Chu, P. B.,Peyton, M. & Birnbaumer, L. Molecular cloning of a widely expressed humanhomologue for the Drosophila trp gene. FEBSLett. 373, 193-198,doi:10.1016/0014-5793(95)01038-g (1995).
4. Guo, W. & Chen,L. Recent progress in structural studies on canonical TRP ion channels. Cell Calcium 83, 102075, doi:10.1016/j.ceca.2019.102075 (2019).
5. Boulay, G. et al. Modulation of Ca(2+) entry bypolypeptides of the inositol 1,4, 5-trisphosphate receptor (IP3R) that bindtransient receptor potential (TRP): evidence for roles of TRP and IP3R in storedepletion-activated Ca(2+) entry. Proc.Natl. Acad. Sci. U. S. A. 96,14955-14960, doi:10.1073/pnas.96.26.14955 (1999).
6. Hartmann, J. et al. TRPC3 channels are required forsynaptic transmission and motor coordination. Neuron 59, 392-398,doi:10.1016/j.neuron.2008.06.009 (2008).
7. Hartmann, J. &Konnerth, A. TRPC3-dependent synaptic transmission in central mammalianneurons. J Mol Med (Berl) 93, 983-989,doi:10.1007/s00109-015-1298-7 (2015).
8. Jia, Y., Zhou, J.,Tai, Y. & Wang, Y. TRPC channels promote cerebellar granule neuronsurvival. Nat. Neurosci. 10, 559-567, doi:10.1038/nn1870 (2007).
9. Zhou, J. et al. Critical role of TRPC6 channelsin the formation of excitatory synapses. Nat.Neurosci. 11, 741-743,doi:10.1038/nn.2127 (2008).
10. Chen, X., Sooch, G.,Demaree, I. S., White, F. A. & Obukhov, A. G. Transient Receptor PotentialCanonical (TRPC) Channels: Then and Now. Cells9, doi:10.3390/cells9091983 (2020).
11. Reiser, J. et al. TRPC6 is a glomerular slitdiaphragm-associated channel required for normal renal function. Nat. Genet. 37, 739-744, doi:10.1038/ng1592 (2005).
12. Winn, M. P. et al. A mutation in the TRPC6 cationchannel causes familial focal segmental glomerulosclerosis. Science 308, 1801-1804, doi:10.1126/science.1106215 (2005).
13. Mio, K. et al. The TRPC3 channel has a largeinternal chamber surrounded by signal sensing antennas. J. Mol. Biol. 367,373-383, doi:10.1016/j.jmb.2006.12.043 (2007).
14. Fan, C., Choi, W.,Sun, W., Du, J. & Lu, W. Structure of the human lipid-gated cation channelTRPC3. Elife 7, doi:10.7554/eLife.36852 (2018).
15. Tang, Q. et al. Structure of thereceptor-activated human TRPC6 and TRPC3 ion channels. Cell Res. 28, 746-755,doi:10.1038/s41422-018-0038-2 (2018).
16. Bai, Y. et al. Structural basis forpharmacological modulation of the TRPC6 channel. Elife 9, e53311,doi:10.7554/eLife.53311 (2020).
17. Kamouchi, M. et al. Properties of heterologouslyexpressed hTRP3 channels in bovine pulmonary artery endothelial cells. J Physiol 518 Pt 2, 345-358, doi:10.1111/j.1469-7793.1999.0345p.x (1999).
18. Lintschinger, B. et al. Coassembly of Trp1 and Trp3proteins generates diacylglycerol- and Ca2+-sensitive cation channels. J. Biol. Chem. 275, 27799-27805, doi:10.1074/jbc.M002705200 (2000).
19. Shi, J. et al. Multiple regulation by calciumof murine homologues of transient receptor potential proteins TRPC6 and TRPC7expressed in HEK293 cells. J Physiol 561, 415-432,doi:10.1113/jphysiol.2004.075051 (2004).
20. Zhang, Z. et al. Activation of Trp3 by inositol1,4,5-trisphosphate receptors through displacement of inhibitory calmodulinfrom a common binding domain. Proc. Natl.Acad. Sci. U. S. A. 98,3168-3173, doi:10.1073/pnas.051632698 (2001).
21. Zitt, C. et al. Expression of TRPC3 in Chinesehamster ovary cells results in calcium-activated cation currents not related tostore depletion. J. Cell Biol. 138, 1333-1341,doi:10.1083/jcb.138.6.1333 (1997).
22. Boulay, G.Ca(2+)-calmodulin regulates receptor-operated Ca(2+) entry activity of TRPC6 inHEK-293 cells. Cell Calcium 32, 201-207,doi:10.1016/s0143416002001550 (2002).
10x Genomics閺傛澘鎼isium HD 瀵偓閸氼垰宕熺紒鍡氬劒閸掑棜椴搁悳鍥╂畱閸忋劏娴嗚ぐ鏇犵矋缁屾椽妫块崚鍡樼€介敍锟�
濞嗐垼绻嬫稉瀣祰Twist閵嗗﹣绗夐弬顓炲綁閸栨牜娈慍RISPR缁涙盯鈧鐗哥仦鈧妴瀣暩鐎涙劒鍔�
閸楁洜绮忛懗鐐寸ゴ鎼村繐鍙嗛梻銊ャ亣鐠佹彃鐖� - 濞e崬鍙嗘禍鍡毿掓禒搴n儑娑撯偓娑擃亜宕熺紒鍡氬劒鐎圭偤鐛欑拋鎹愵吀閸掔増鏆熼幑顔垮窛閹貉傜瑢閸欘垵顫嬮崠鏍掗弸锟�
 瀵洟顣悰灞肩瑹鑱絴鑱介懕姘卞妽妤癸妇澹掔紒妯挎皑娴狅綀闃跨紒鍕劅閺佺繝缍嬬憴锝呭枀閺傝顢�>>
瀵洟顣悰灞肩瑹鑱絴鑱介懕姘卞妽妤癸妇澹掔紒妯挎皑娴狅綀闃跨紒鍕劅閺佺繝缍嬬憴锝呭枀閺傝顢�>>  閵嗗苯銇囩亸蹇涚炊缁讳浇鍋涙稉搴′淮鎼撮顓搁悶鍡愨偓宥嗗瘹鐎靛吋鎹i幎銉礉閻愮懓鍤崡鍐插讲閸忓秷鍨傛0鍡楀絿閻㈤潧鐡欓悧鍫熷灗鐎圭偘缍嬪ù閿嬪Г>>
閵嗗苯銇囩亸蹇涚炊缁讳浇鍋涙稉搴′淮鎼撮顓搁悶鍡愨偓宥嗗瘹鐎靛吋鎹i幎銉礉閻愮懓鍤崡鍐插讲閸忓秷鍨傛0鍡楀絿閻㈤潧鐡欓悧鍫熷灗鐎圭偘缍嬪ù閿嬪Г>>  閹活厾顫濋崡鏇犵矎閼崇偞绁存惔锟�-濞e崬鍙嗘禍鍡毿掓潻娆撱€嶅锝呮躬閺€鐟板綁閹存垳婊戝鈧仦鏇狀潠鐎涳妇鐖虹粚鍓佹畱閹垛偓閺堬拷>>
閹活厾顫濋崡鏇犵矎閼崇偞绁存惔锟�-濞e崬鍙嗘禍鍡毿掓潻娆撱€嶅锝呮躬閺€鐟板綁閹存垳婊戝鈧仦鏇狀潠鐎涳妇鐖虹粚鍓佹畱閹垛偓閺堬拷>>  娑撴牜鏅拋妤€鎮昑hermo Fisher鐠ф盯绮鐐扮瑯鐏忔梻顫栭幎鈧幏娑滀粧Field Application Scientist閵嗕府arketing Develop缁涘浜存担宥忕礉鐠囷附鍎忕拠閿嬬叀閻鏁撻悧鈺呪偓姘眽閹靛秴绔堕崷鐑樼埉閻╊噯绱�>>
娑撴牜鏅拋妤€鎮昑hermo Fisher鐠ф盯绮鐐扮瑯鐏忔梻顫栭幎鈧幏娑滀粧Field Application Scientist閵嗕府arketing Develop缁涘浜存担宥忕礉鐠囷附鍎忕拠閿嬬叀閻鏁撻悧鈺呪偓姘眽閹靛秴绔堕崷鐑樼埉閻╊噯绱�>>  閸氼剝顕╂潻鍥ф偋閿涚喕绉存潻锟�14婢垛晛鐤勬宀€鐛ラ崣锝囨畱閼叉繆鍓扮紒鍡氬劒閿涳拷>>
閸氼剝顕╂潻鍥ф偋閿涚喕绉存潻锟�14婢垛晛鐤勬宀€鐛ラ崣锝囨畱閼叉繆鍓扮紒鍡氬劒閿涳拷>>  生物通微信公众号
生物通微信公众号
知名企业招聘
今日动态 | 人才市场 | 新技术专栏 | 中国科学人 | 云展台 | BioHot | 云讲堂直播 | 会展中心 | 特价专栏 | 技术快讯 | 免费试用
版权所有 生物通
Copyright© eBiotrade.com, All Rights Reserved
联系信箱:
粤ICP备09063491号
