
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Protein & Cell | 杨竞团队揭示肠神经系统退行性病..
【字体: 大 中 小 】 时间:2021年05月04日 来源:北京大学前沿交叉学科研究院
编辑推荐:
神经退行性病变(neurodegeneration)是重要的神经系统疾病之一。其中,轴突退行性病变(axonal degeneration)广泛存在于创伤性神经损伤、化疗神经损伤、糖尿病神经损伤、多发性硬化症、青光眼等各类神经退行性疾病,.....
神经退行性病变(neurodegeneration)是重要的神经系统疾病之一。其中,轴突退行性病变(axonal degeneration)广泛存在于创伤性神经损伤、化疗神经损伤、糖尿病神经损伤、多发性硬化症、青光眼等各类神经退行性疾病,通过直接破坏神经环路而导致神经功能障碍。正因如此,过去几十年的研究一直试图阐释轴突退行性病变的分子信号机制。
生命科学联合中心杨竞研究员在博士后期间参与鉴定了控制轴突退行性病变的核心信号蛋白SARM1(Osterloh et al., Science 2012)。杨竞研究员的随后工作揭示SARM1蛋白与轴突能量代谢有着内在的紧密关联(详见BioArt报道:Nature | 张哲/杨竞组共同揭示NAD+介导的神经细胞“杀手”Sarm1蛋白的活性调节机制)(Yang et al., Cell 2015; Jiang et al., Nature 2020)。目前,大量研究已经表明,SARM1蛋白介导的信号通路控制各类神经损伤条件下的轴突退行性病变,从而使得SARM1蛋白成为治疗神经退行性病变的新的药物靶点。
值得注意的是,传统观念认为轴突退行性病变必然导致负面的、有害的神经病理后果,那么能够触发这一病理过程的SARM1信号通路为何在进化中得以保存则是领域内的未解问题。事实上,轴突退行性病变是否可能在特定疾病条件下发挥有益作用从未有所报道。这一问题的解答,对于全面理解神经退行性病变至关重要,并且对于相关治疗药物开发中可能产生的副作用起到预警。
肠神经系统(enteric nervous system)能够不依赖于中枢神经系统和外周神经系统而独立运作(也经常被称为“第二大脑” ),对于肠道的各项生理功能起到重要控制功能。但是,针对肠神经系统的病理性变化尤其是退行性病变极少研究报道。
针对上述研究空白,2021年4月19日,杨竞课题组在Protein & Cell期刊上发表了文章(研究长文)Sarm1-mediated neurodegeneration within the enteric nervous system protects against local inflammation of the colon,揭示了急性炎症条件下肠道内儿茶酚胺 (catecholaminergic)神经退行性病变的现象,并阐释这一神经病理现象受控于SARM1信号通路且出乎意料的发挥对抗疾病的保护性功能。
作为这项研究的入手点,杨竞课题组利用先进的全组织免疫染色和三维荧光成像技术,在领域内首次系统性解析了成年小鼠、猕猴、人类肠神经系统的三维分布。随后,研究发现在溃疡性结肠炎(ulcerative colitis)的人类结肠组织中存在大规模的儿茶酚胺能神经损伤。与之相似的,在葡聚糖硫酸钠(DSS)诱导的小鼠急性结肠炎模型中,同样存在儿茶酚胺能神经的退行性病变;相反的,肠神经系统中的乙酰胆碱能神经在DSS诱导结肠炎中没有明显变化。进一步的,杨竞课题组证明这一肠神经系统的退行性病变现象是由TNF-alpha诱发且依赖于SARM1,表现为Sarm1基因敲除可以显著阻断DSS诱导结肠炎中儿茶酚胺能神经的损伤。然而令人惊讶的,Sarm1基因敲除(Sarm1-/-)或儿茶酚胺能神经特异性Sarm1基因敲除(Th-Cre; Sarm1fl/fl)均导致结肠炎症状的显著恶化。反之,药理学方法移除肠神经系统中的儿茶酚胺能神经或化学遗传学抑制这些神经的活性,则可以明显改善结肠炎的疾病程度。
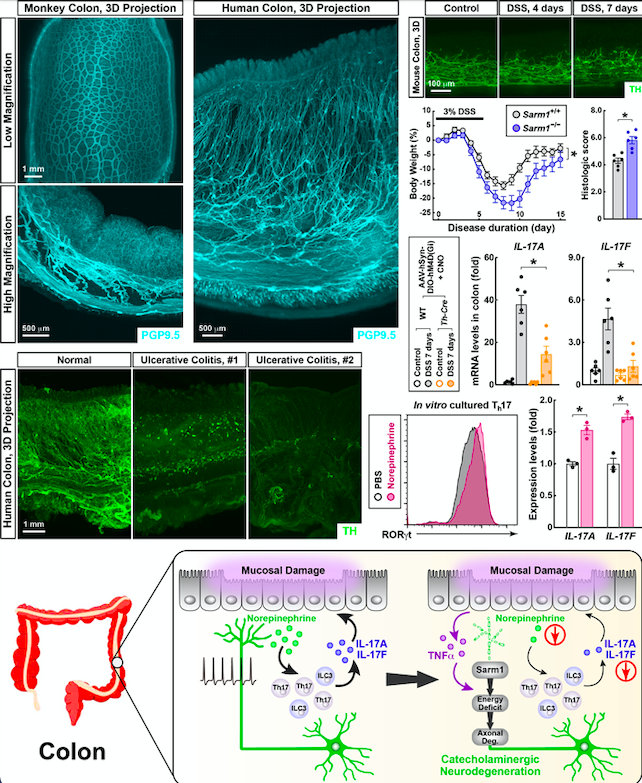
为了探索这一全新发现的具体机制,杨竞课题组发现儿茶酚胺能神经递质去甲肾上腺素(norepinephrin)能够促进Th17淋巴细胞和ILC3s天然淋巴样细胞的IL-17促炎因子细胞表达。去甲肾上腺素这一促炎功能(pro-inflammatory function)是通过提高上述两类免疫细胞中重要转录因子RORgt的表达水平而实现。这些研究成果提示,在结肠炎条件下产生的TNF-alpha触发SARM1信号通路而引起儿茶酚胺能神经退行性病变,以减少IL-17促炎细胞因子的产生。肠道内这一神经-免疫环路中,儿茶酚胺能神经起到“保险丝”的功能,即通过熔断机制避免过量的炎症反应对于组织的可能损伤。综上所述,杨竞课题组的最新研究揭示了神经退行性病变在维持肠道内神经-免疫稳态中的全新的、以往未知的有益作用。值得一提的是,康奈尔大学医学院David Simon教授将以Commentary形式对该项工作进行了点评。
杨竞课题组致力于神经-免疫调控(neuroimmune regulation)的前沿方向,通过整合全组织三维荧光成像技术、疾病动物模型、非人灵长类及人类临床样品、神经生物学、免疫学、生理学等多学科手段,致力于系统性阐明神经-免疫调控的全新机制和重要作用。课题组近年来的工作揭示了经典免疫器官和屏障组织中神经调节的关键机制,同时证明了局部神经退行性病变参与免疫调控的创新概念。这些研究成果开拓了对于生理或病理条件下神经-免疫调控的崭新视角,同时为治疗各类免疫相关疾病提供了关键的切入点。
原文链接:
https://link.springer.com/article/10.1007/s13238-021-00835-w