
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Nature Plants揭示光合固碳关键酶RuBisCO组装的精细调控机理
【字体: 大 中 小 】 时间:2021年03月30日 来源:Nature Plants
编辑推荐:
蓝藻分子伴侣Raf1协助核酮糖-1,5-二磷酸羧化酶/加氧酶(RuBisCO)组装的分子机理
中国科学技术大学微尺度物质科学国家研究中心和生命科学与医学部周丛照教授&陈宇星教授课题组阐明了蓝藻分子伴侣Raf1协助核酮糖-1,5-二磷酸羧化酶/加氧酶(RuBisCO)组装的分子机理,发现RuBisCO组装和成熟过程的多层次精细动态调控网络,为人工改造RuBisCO以提高光合作用效率奠定了基础。该研究成果以“Molecular basis for the assembly of RuBisCO assisted by the chaperone Raf1”为题于2020年5月25日在线发表在《Nature Plants》上。
RuBisCO是地球上丰度最高的酶,总质量约为7亿吨,催化光合作用暗反应的碳同化过程,每年将地球上超过1000亿吨CO2固定为有机物。然而RuBisCO的催化效率极低,每个RuBisCO全酶每秒钟只能催化3~10个CO2分子的转化。为了应对环境中CO2浓度的不断降低,蓝藻进化出CO2浓缩机制(CCM),通过羧酶体包裹RuBisCO并高度富集CO2,从而提高催化效率。蓝藻和植物中的I型RuBisCO全酶由8个大亚基RbcL和8个小亚基RbcS组成,其组装和成熟过程需要多个分子伴侣的帮助,包括GroEL/ES、RbcX和Raf1等。将蓝藻的CCM系统引入植物被认为是一种潜在的提高植物光合效率的方法,然而迄今为止对于RuBisCO组装和成熟的精细过程仍然不清楚,极大限制了RuBisCO的工程改造和活性优化。
该研究基于蓝藻分子伴侣Raf1以及Raf1和RuBisCO大亚基RbcL复合体的晶体结构分析,精细展示了Raf1与RbcL的相互作用界面。Raf1以交错的二体形式存在;当与RbcL结合时,Raf1的两个结构域相对旋转,形成类似镊子的结构夹住一个RbcL二体,进而稳定RbcL八聚体。同时,通过冷冻电镜单颗粒技术解析了RuBisCO和Raf1复合物一系列不同中间状态的三维结构,直观展示了RbcS替换Raf1形成全酶过程中的多步动态构象。此外,通过生化手段发现Raf1能够拮抗支架蛋白CcmM介导的RuBisCO堆积及相变过程,进而可能参与调控RuBisCO的堆积和羧酶体内核的形成。基于上述实验结果,作者提出了Raf1调控蓝藻RuBisCO组装、成熟以及在羧酶体内核中规则堆积的分子机理。该研究为深入理解RuBisCO的组装和功能及其应用改造奠定了分子基础。
中国科大周丛照教授、陈宇星教授和江永亮副教授为该论文的共同通讯作者。博士生夏凌云、副教授江永亮和博士生孔文文为该论文共同第一作者。晶体衍射数据收集在上海光源完成,冷冻电镜数据收集工作在中科院生物物理所生物成像中心完成。该研究得到国家自然科学基金委、中国科学院、科技部和中国科大等项目的资助。
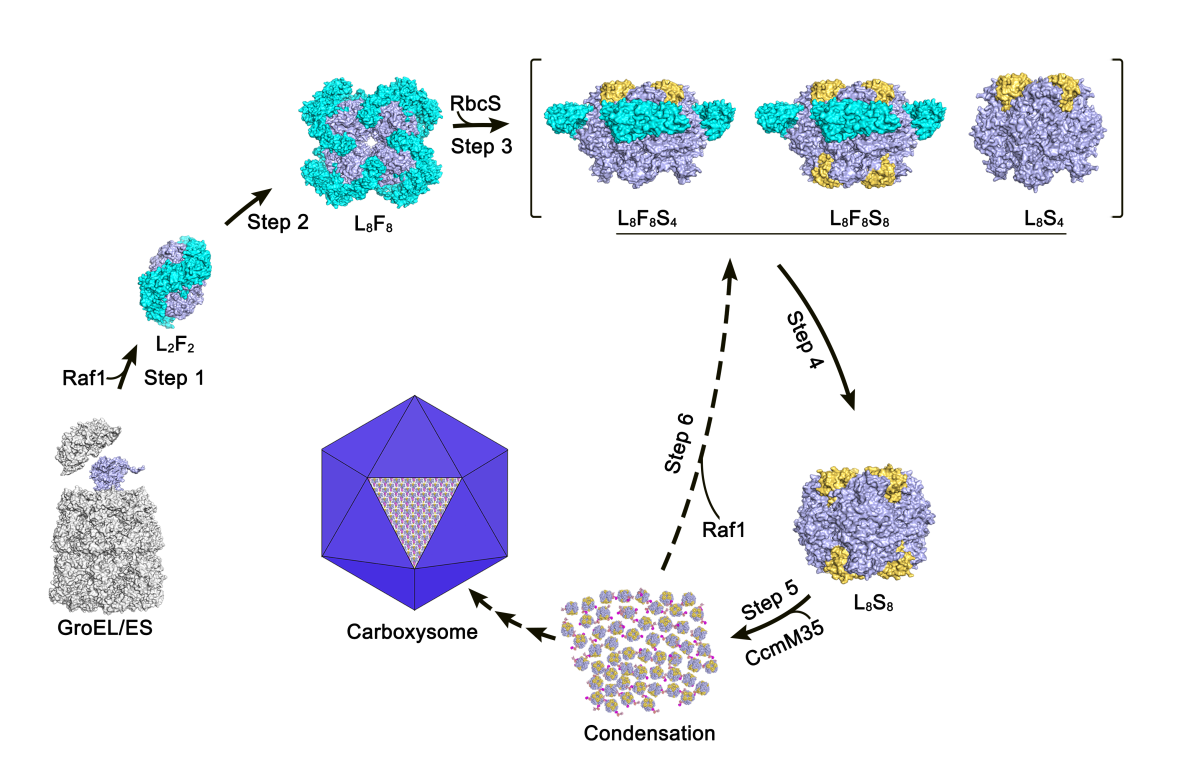
Raf1调控RuBisCO组装和成熟的模式图
文章链接:https://www.nature.com/articles/s41477-020-0665-8
中国科学技术大学微尺度物质科学国家研究中心 生命科学与医学部