
-

生物通官微
陪你抓住生命科技
跳动的脉搏
Nature|陈雷组报道降糖药恩格列净抑制人源SGLT2-MAP..
【字体: 大 中 小 】 时间:2021年12月11日 来源:北京大学前沿交叉学科研究院
编辑推荐:
葡萄糖是地球上绝大多数生物最重要的能量来源之一。葡萄糖经血液循环被运输至身体各个器官。在血液流经肾脏时,绝大部分葡萄糖会被滤出,然后再被重吸收回血液。肾脏每天重吸收的葡萄糖达到180g,才保证了最终排出的尿液中不含葡萄糖1。因此,肾脏是维持血浆中葡萄.....
葡萄糖是地球上绝大多数生物最重要的能量来源之一。葡萄糖经血液循环被运输至身体各个器官。在血液流经肾脏时,绝大部分葡萄糖会被滤出,然后再被重吸收回血液。肾脏每天重吸收的葡萄糖达到180g,才保证了最终排出的尿液中不含葡萄糖1。因此,肾脏是维持血浆中葡萄糖水平的重要器官。
肾脏中负责葡萄糖重吸收的主要蛋白为钠-葡萄糖共转运蛋白(SGLT),其属于溶质载体转运子超家族5A(solute carrier transporter 5A)中的一员,与GLUT(SLC2A)截然不同2。SGLT蛋白利用钠离子的电化学势驱动葡萄糖逆浓度梯度转运。因此,在转运葡萄糖的同时,伴随着钠离子的生电转运2。在人类中,SGLT 共发现有六种亚型,其中在肾脏中主要起作用的为SGLT1和SGLT2。SGLT2 位于肾脏近曲小管的S1和S2节段,负责原尿中90%葡萄糖的重吸收3,并且其活性依赖于附属亚基MAP17 4。SGLT1 位于近曲小管 S3 节段,负责残余葡萄糖的重吸收。SGLT2的失活突变会引起家族性肾性尿糖,这类患者除了尿糖高以外没有其他明显的临床症状3,4。此外,早在1886年,德国药学家约瑟夫冯梅林发现从苹果树根皮中萃取的天然产物根皮苷(Phlorizin)可以使动物多尿、排出尿糖、减轻体重。随后的研究发现:根皮苷就是SGLT的天然抑制剂。上世纪80年代末,90年代初,编码负责葡萄糖重吸收的SGLT1和SGLT2蛋白的基因也先后被克隆出来5,6。这一系列在基础研究方面的进展促使制药界开始关注SGLT2抑制剂的开发。其理念是希望通过抑制SGLT蛋白的功能,使原尿中的葡萄糖无法被重吸收,从而通过尿液排出体外,达到间接降血糖的目的。与SGLT2相比,SGLT1 在肾脏中仅负责重吸收小部分葡萄糖,并且还在肠道中负责葡萄糖的摄取7,抑制其功能后的降糖效果和副作用有待进一步研究。所以SGLT2成为治疗糖尿病的重要小分子药物靶点之一。
基于天然产物根皮苷的结构,目前,已有多种SGLT2的特异性抑制剂被成功开发出来,并应用于临床用于治疗2型糖尿病,比如恩格列净(Empagliflozin)、卡格列净(Canagliflozin)、达格列净(Dapagliflozin)等8,其中恩格列净对SGLT2的选择性是SGLT1的2500倍9。这些药物降糖疗效显著,验证了“通过尿出糖来降血糖”这一治疗思路的正确性。除了降血糖的功能外,这三种SGLT2的抑制剂还有治疗心衰、肾脏保护等多种临床效果10,被誉为“神药”。尽管SGLT2抑制剂在2型糖尿病的治疗中具有重要价值,目前仍不清楚这些药物是如何抑制SGLT2蛋白功能的。
2021年12月8日,北大-清华生命科学联合中心(CLS)、北京大学未来技术学院分子医学研究所陈雷课题组在《Nature》杂志发表题目为 “Structural basis of inhibition of the human SGLT2-MAP17 glucose transporter” 的文章,报导了人源SGLT2-MAP17复合物与抑制剂恩格列净结合的2.95?冷冻电镜结构。链接见:https://www.nature.com/articles/s41586-021-04212-9。
SGLT2分子量仅为~73 kDa,附属亚基MAP17为单次跨膜的膜蛋白。二者均没有明显的可溶区结构域。利用冷冻电镜技术解析SGLT2-MAP17异源二聚体的结构具有挑战。作者们经过多年积累和摸索,创新性地采用“三接头固定”的策略将GFP融合在SGLT2胞内的loop区,将GFP纳米抗体融合在MAP17胞内端11,利用GFP和nanobody的高亲和力成功地把GFP-nanobody复合物嵌合在SGLT2-MAP17胞内侧,从而为冷冻电镜单颗粒重构提供了指示性标记。作者在克服了蛋白纯化,纳米盘组装、冷冻样品制备和数据处理等一系列困难之后,最终获得了SGLT2-MAP17复合物和抑制剂结合的分辨率为2.95 ?的电子密度,并搭建了原子模型。
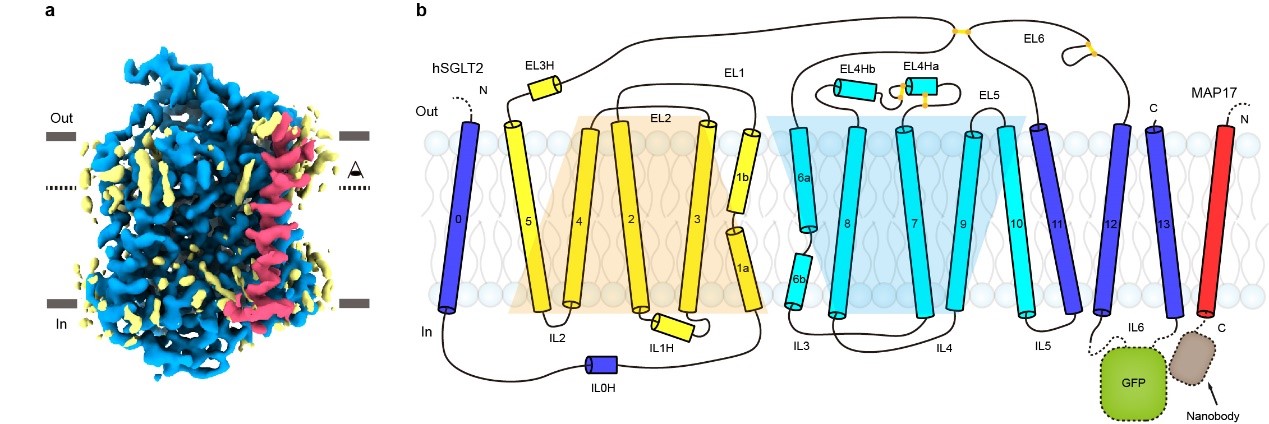
图1. SGLT2-MAP17蛋白的电子密度图和拓扑示意图。
SGLT2为14次跨膜蛋白,其中TM1-10为转运的核心结构,TM1-5和TM6-10在拓扑上为反向重复的结构,转运的核心结构和原核生物亮氨酸转运蛋白(LeuT)类似。TM0,TM11-13在核心结构的周围,附属亚基MAP17通过疏水相互作用与TM13结合(图1)。此外,作者还发现,真核生物SGLT家族蛋白在胞外葡萄糖入口的上面,有一个盖子样的结构,此结构由四对二硫键来稳定(图2)。在胞内侧,长的IL6与IL1和IL5发生相互作用(图2),这些相互作用可能对SGLT2的功能非常重要。
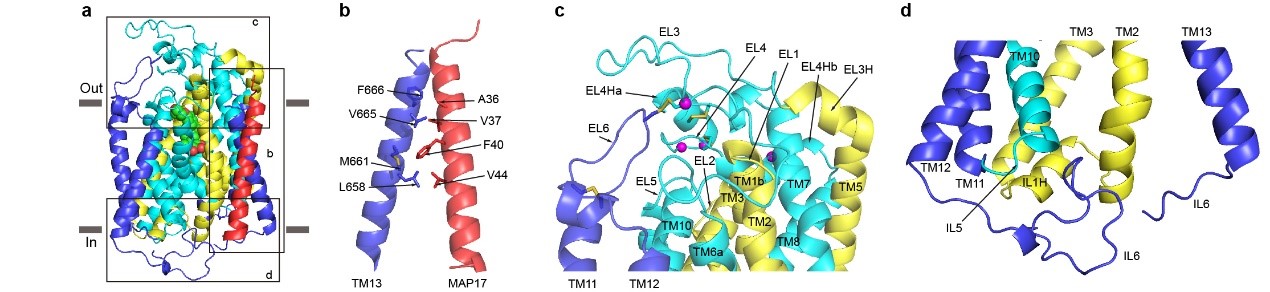
图2. SGLT2和MAP17的相互作用及真核生物SGLT2特异的特征
抑制剂恩格列净结合在SGLT2蛋白的中间,抑制剂的葡萄糖基占据了葡萄糖的结合位点,葡萄糖基的羟基与SGLT2的氨基酸发生了极性相互作用。抑制剂的糖苷配基从葡萄糖结合位点往外延伸,直到蛋白外侧,将SGLT2锁定在向外开放状态(outward-open)(图3)。抑制剂的氯苯基和SGLT2的H80相互作用,中间的苯基与SGLT2的F98、V95、L84和F453通过疏水相互作用,末端的四氢呋喃基团和SGLT2的F98、L274氨基酸相互作用(图3)。作者将SGLT2的F98和F453分别突变为丙氨酸发现,突变的SGLT2降低了和抑制剂的结合,减弱了抑制剂的抑制作用。此外,作者还将和抑制剂结合的SGLT2氨基酸突变为SGLT1对应的氨基酸,发现抑制剂的抑制效果也减弱。这在一定程度上解释了恩格列净对SGLT2相较于SGLT1的高选择性。
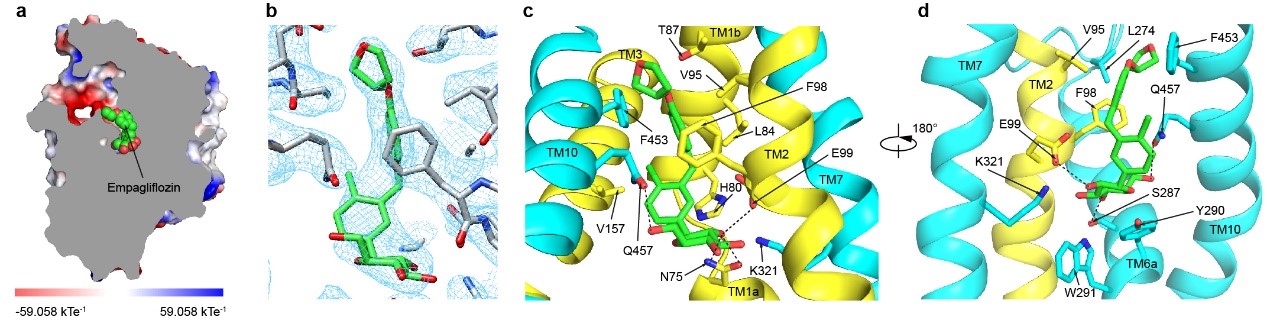
图3. 抑制剂恩格列净的结合位点
作者捕捉到的与抑制剂结合的SGLT2的向外开放状态和原核生物vSGLT的向内开放状态有很大的差别。在向外开放状态的SGLT2中,葡萄糖的出口是关闭的。通过与vSGLT结构的比较发现,TM1、TM2、TM6和TM7的移动是SGLT2葡萄糖出口打开的关键。
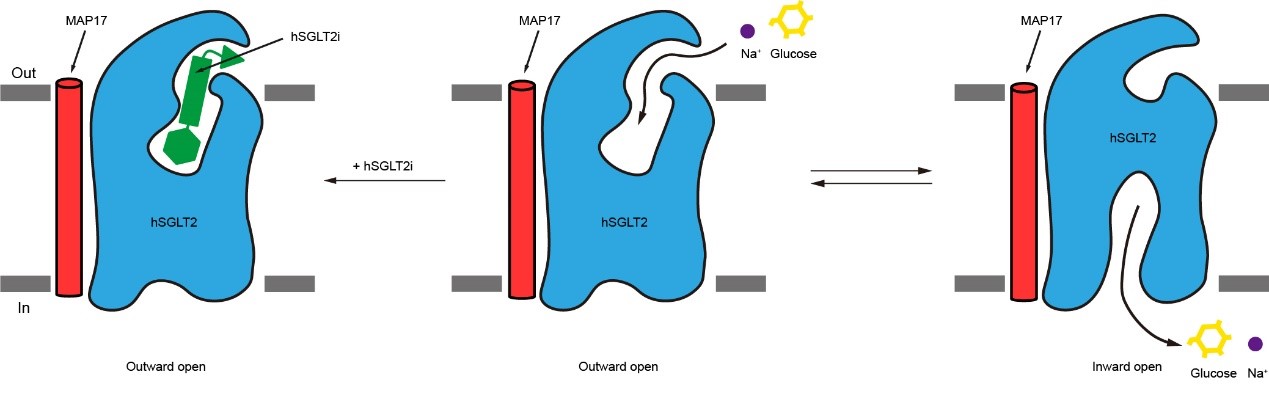
图4. SGLT2抑制剂的工作机制模式图
综上所述,作者通过冷冻电镜对SGLT2-MAP17复合物和抑制剂的结构进行解析,发现抑制剂将SGLT2锁定在向外开放状态,确定了SGLT2抑制剂的结合位点,阐释了抑制剂抑制SGLT2的工作机制(图4),为SGLT家族抑制剂的进一步优化提供了结构基础。
北京大学未来技术学院分子医学所博士研究生牛延革为本论文的第一作者,北大-清华生命科学联合中心(CLS)陈雷研究员为论文的通讯作者。该研究还得到陈雷课题组的博士生刘锐和博士后管成成,CLS、北京大学未来技术学院陈知行研究员及其博士生张源利用精湛的荧光标记技术,为本课题提供了高纯度荧光标记的葡萄糖底物。勃林格殷格翰药业有限公司(Boehringer-Ingelheim Pharma, GmbH & Co KG)的Stefan Hoerer和Herbert Nar为本课题提供了恩格列净及其同位素标记物。在该课题开展过程中,勃林格殷格翰中国分公司的张巍怡和叶俊青给予了大力协助。该工作冷冻电镜样品制备、筛选和采集在北京大学电镜平台和冷冻电镜平台完成,得到了李雪梅、郭振玺、邵博、裴霞和王国鹏等人的帮助。台湾大学的许丽卿(Lih-Ching Hsu)教授馈赠了1-NBDG样品用于课题的前期摸索。同位素实验由北京大学生科院的黄士堂协助完成。该项目的数据处理获得了北京大学CLS北极星计算平台及未名超算平台的硬件和技术支持。博士后管成成受到了勃林格殷格翰公司博士后项目的支持;该课题得到国家自然科学基金、CLS等经费支持。陈雷实验室长期致力于代谢类疾病和心血管疾病药物靶点的工作机制,先后解析了胰岛细胞葡萄糖感受器KATP,一氧化氮受体sGC等结构,希望对此方向感兴趣的研究生及博士后加入。
参考文献:
1 DeFronzo, R. A., Norton, L. & Abdul-Ghani, M. Renal, metabolic and cardiovascular considerations of SGLT2 inhibition. Nat Rev Nephrol 13, 11-26, doi:10.1038/nrneph.2016.170 (2017).
2 Wright, E. M., Loo, D. D. & Hirayama, B. A. Biology of human sodium glucose transporters. Physiol. Rev. 91, 733-794, doi:10.1152/physrev.00055.2009 (2011).
3 Kanai, Y., Lee, W. S., You, G., Brown, D. & Hediger, M. A. The human kidney low affinity Na+/glucose cotransporter SGLT2. Delineation of the major renal reabsorptive mechanism for D-glucose. J. Clin. Invest. 93, 397-404, doi:10.1172/JCI116972 (1994).
4 Coady, M. J. et al. MAP17 Is a Necessary Activator of Renal Na+/Glucose Cotransporter SGLT2. J. Am. Soc. Nephrol. 28, 85-93, doi:10.1681/ASN.2015111282 (2017).
5 Hediger, M. A., Coady, M. J., Ikeda, T. S. & Wright, E. M. Expression cloning and cDNA sequencing of the Na+/glucose co-transporter. Nature 330, 379-381, doi:10.1038/330379a0 (1987).
6 Wells, R. G. et al. Cloning of a human kidney cDNA with similarity to the sodium-glucose cotransporter. Am. J. Physiol. 263, F459-465, doi:10.1152/ajprenal.1992.263.3.F459 (1992).
7 Gorboulev, V. et al. Na+-D-glucose Cotransporter SGLT1 is Pivotal for Intestinal Glucose-Absorption and Glucose-Dependent Incretin Secretion. Diabetes 61, 187-196, doi:10.2337/db11-1029 (2012).
8 Genuardi, M. V. & Mather, P. J. The dawn of the four-drug era? SGLT2 inhibition in heart failure with reduced ejection fraction. Ther Adv Cardiovasc Dis 15, 17539447211002678, doi:10.1177/17539447211002678 (2021).
9 Williams, D. M., Nawaz, A. & Evans, M. Sodium-Glucose Co-Transporter 2 (SGLT2) Inhibitors: Are They All the Same? A Narrative Review of Cardiovascular Outcome Trials. Diabetes Ther 12, 55-70, doi:10.1007/s13300-020-00951-6 (2021).
10 Zinman, B. et al. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N. Engl. J. Med. 373, 2117-2128, doi:10.1056/NEJMoa1504720 (2015).
11 Kirchhofer, A. et al. Modulation of protein properties in living cells using nanobodies. Nature Structural & Molecular Biology 17, 133-U162, doi:10.1038/nsmb.1727 (2010).