
-

生物通官微
陪你抓住生命科技
跳动的脉搏
药学院张晓坤教授团队发文Nature子刊揭示衰老相关分子机制
【字体: 大 中 小 】 时间:2021年12月06日 来源:厦门大学药学院
编辑推荐:
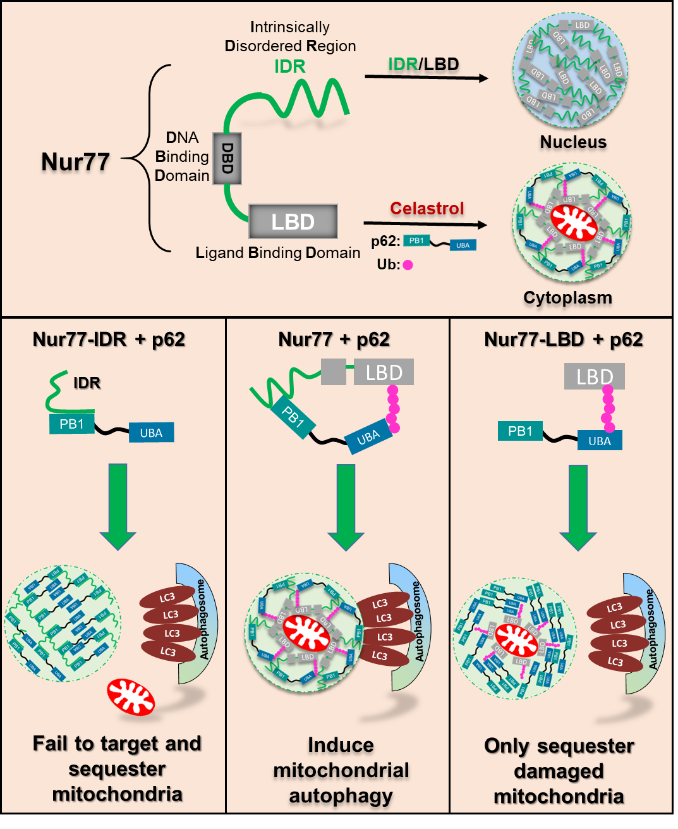
10月13日,厦门大学药学院张晓坤教授课题组在《自然》期刊的子刊《自然?通讯》(Nature Communications)杂志上发表重要创新成果。这项研究首次揭示了孤儿核受体Nur77能够发生相分离、进而通过相分离介导了线粒体自噬的分子机制,发现了这一机制在衰老过程和疾病发生发展中的生理功能。
线粒体是细胞内的一个重要细胞器,不仅是细胞的能量加工厂,还参与诸多细胞过程,其损伤及功能缺陷与人类衰老和癌症、代谢紊乱、神经退行性疾病等严重的疾病有关。因而调控线粒体功能、清除损伤线粒体是药物开发的一条有效途径。张晓坤教授团队长期聚焦核受体Nur77的线粒体调控功能研究, 2017年在《细胞》杂志子刊《分子细胞》(Molecular Cell)发表了一项重要成果,发现从传统药用植物雷公藤中分离提取的雷公藤红素(Celastrol)能够结合于孤儿核受体Nur77,通过自噬途径, 清除损伤线粒体,从而抑制炎症及肥胖等相关疾病。然而, 核受体Nur77如何清除损伤线粒体的分子机制还需进一步研究。
近年来,科学家们发现相分离调控细胞内的各种信号传导通路,在人类健康中起关键作用,是药物开发的一个崭新领域,但相分离是如何参与隔离大型细胞器,例如清除损伤线粒体,其中的机制仍然不是很清楚。张晓坤课题组的研究,首次发现核受体Nur77能够通过其N端的无序结构区域发生相分离,并介导了损伤线粒体自噬的分子机制。研究发现雷公藤红素促进了Nur77 C端的LBD结构域泛素化与自噬受体p62的UBA结构域相互作用,形成了隔离损伤的线粒体无膜细胞器,并通过Nur77 N端的无序结构区能够与p62的PB1结构域相互作用,通过促进p62相分离颗粒的大小和流动性,完成了损伤线粒体在溶酶体中的清除。该研究揭示了线粒体自噬需要Nur77和p62的多价相互作用所形成的相分离的分子作用机制, 同时也证实Nur77介导的线粒体自噬在衰老及其它疾病发生发展中的功能, 对研究核受体家族成员N 端无序结构区域的生物学功能,及开发靶向线粒体的雷公藤红素药物提供了一个新思路。
厦门大学药学院彭双周博士和陈晓惠博士后为论文共同第一作者,张晓坤教授为通讯作者。藤济生物医药科技有限公司的苏迎博士团队参与了该研究工作。该工作得到了国家自然科学基金委、海洋经济创新地区域示范开发项目、福建省科技厅、厦门市科技局、中国博士后科学基金等的经费支持。
文章题目为Phase separation of Nur77 mediates celastrol induced mitophagy by promoting the liquidity of p62/SQSTM1 condensates
论文链接:https://www.nature.com/articles/s41467-021-26295-8
(图/文:药学院)